��Ŀ����
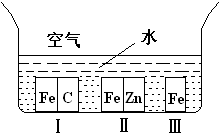
��14�֣���1������ͼ��ʾ�������ڢ����ֲ�ͬ�Ļ����У�������ʴ�������ɴ�С��˳���ǣ�����ţ�_________ ______��
��2�������к�����ϩ�����Լ�Ϊ ��
��Ӧ�Ļ�ѧ����ʽΪ ��
��3����10L�ܱ������г���2molA��1molB�������Ļ�ѧ��Ӧ��3A(g)+B(g)  C(g)
C(g)
+2D(g)��2min��Ӧ�ﵽƽ�⣬����ͬ�¶��£����ƽ��ʱ�����������ѹǿ�Ƿ�Ӧǰ��5/6������д���пհף�
��������B��ʾ��2min�ڵ�ƽ����Ӧ����Ϊ ��
��ƽ��ʱ��A��Ũ��Ϊ mol/L��
��4���ҹ�ӵ����ȫ������Ȩ������ȼ�ϵ�س��ڱ������˻��ڼ�Ϊ�˶�Ա�ṩ����ij������ȼ�ϵ�صĵ��ҺΪKOH��Һ����ظ�����ӦΪ ��
������Ӧ ��
��1���� ��2����ˮ CH2==CH2 + Br2��CH2Br-CH2Br ��3����0.025mol/L.min ��0.05
��4��H2-2e-+2OH- ==2H2O O2+4e��+2H2O==4OH-
����

��ϰ��ϵ�д�
�����Ŀ
 A������ѡѧ����ѧ�������������
A������ѡѧ����ѧ���������������1������ͼ��ʾ�������ڢ����ֲ�ͬ�Ļ����У�������ʴ�������ɴ�С��˳����
��2�����ȴ�����һ���ƻ�����������ʣ��ڴ���ƽ�����У����ȴ����������ߵ�����ֽ����ԭ�ӣ���ԭ�Ӳ��������йط�Ӧ��
��Cl+O3��ClO+O2����O3��O+O2����ClO��Cl+O2
���з�Ӧ���ܷ�Ӧʽ��
��3��̼�������dz��������ɼ�����Ҫ����Ϊ���ڼ��������²��������壬ʹʳƷ������ɣ���д��̼���������ȷֽ�Ļ�ѧ����ʽ
��4��������Դ���ķ�����
A������ B������ C���ѷʷ� D��������շ�
B����ѡѧ����ѧ��Ӧԭ������������
�跴Ӧ��Fe��s��+CO2��g���TFeO��s��+CO��g����ƽ�ⳣ��ΪK1����Ӧ��Fe��s��+H2O��g���TFeO��s��+H2��g����ƽ�ⳣ��K2���ڲ�ͬ�¶��£�K1��K2��ֵ���£�
| �¶� | K1 | K2 |
| 973K | 1.47 | 2.38 |
| 1173K | 2.15 | 1.67 |
��2�����з�Ӧ��CO2��g��+H2��g���TCO��g��+H2O��g��д���÷�Ӧ��ƽ�ⳣ��K3����ѧ����ʽ��K3�T
��3����д�Ȼ�ѧ����ʽ��
��1mol N2��g��������O2��g����Ӧ������NO2��g��������68KJ������
��NH3��g��ȼ������NO2��g����H2O��g������֪
��1��2H2��g��+O2��g���T2H2O��g����H�T-483.6kJ/mol
��2��N2��g��+2O2��g���T2NO2��g����H�T+67.8kJ/mol
1��N2��g��+3H2��g���T2NH3��g����H�T-92.0kJ/mol
NH3��g��ȼ������NO2��g����H2O ��g���Ȼ�ѧ����ʽ��
 ѡ����[��ѧ--ѡ��ѧ������]
ѡ����[��ѧ--ѡ��ѧ������]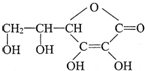 �����ķ���ʽ��
�����ķ���ʽ��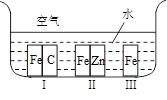 ��1������ͼ��ʾ�������ڢ����ֲ�ͬ�Ļ����У�������ʴ�������ɴ�С��˳���ǣ�����ţ�_______________��
��1������ͼ��ʾ�������ڢ����ֲ�ͬ�Ļ����У�������ʴ�������ɴ�С��˳���ǣ�����ţ�_______________��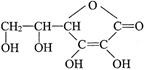 �����ķ���ʽ��______________���������ܷ��λ�Ѫ�����ֳ�Ϊ_________________����ά����C��Һ�е�����ɫʯ����Һ����Һ��ɫ��죬˵��ά����C��Һ����__________�ԣ���ά����C��Һ�е���������ɫ�ĺ��е��۵ĵ�ˮ���ɹ۲쵽��������______________��˵��ά����C����_______________�ԡ�
�����ķ���ʽ��______________���������ܷ��λ�Ѫ�����ֳ�Ϊ_________________����ά����C��Һ�е�����ɫʯ����Һ����Һ��ɫ��죬˵��ά����C��Һ����__________�ԣ���ά����C��Һ�е���������ɫ�ĺ��е��۵ĵ�ˮ���ɹ۲쵽��������______________��˵��ά����C����_______________�ԡ�

 C(g)
C(g)