题目内容
10.7g氯化铵与足量氢氧化钙混合共热,最多可制得:
(1)NH3的物质的量是多少?(2)将制得的氨气全部溶于水制成2L溶液,所得氨水物质的量浓度为多少?
解:10.7g氯化铵的物质的量为:n= =
=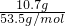 =0.2mol,根据方程式计算:
=0.2mol,根据方程式计算:
2NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O
CaCl2+2NH3↑+2H2O
2mol 2mol
0.2mol n
n=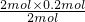 =0.2mol,
=0.2mol,
将制得的氨气全部溶于水制成2L溶液,所得氨水物质的量浓度为:c= =
=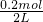 =0.1mol,
=0.1mol,
答:(1)NH3的物质的量是0.2mol;(2)所得氨水物质的量浓度为0.1mol/L.
分析:根据n= 计算10.7g氯化铵的物质的量,反应的化学方程式为2NH4Cl+Ca(OH)2
计算10.7g氯化铵的物质的量,反应的化学方程式为2NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O,根据方程式计算生成的氨气的物质的量,进而计算氨水物质的量浓度.
CaCl2+2NH3↑+2H2O,根据方程式计算生成的氨气的物质的量,进而计算氨水物质的量浓度.
点评:本题考查物质的量应用于化学方程式的计算,题目难度不大,注意化学方程式的书写以及物质的量的有关计算公式的运用.
 =
=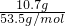 =0.2mol,根据方程式计算:
=0.2mol,根据方程式计算:2NH4Cl+Ca(OH)2
 CaCl2+2NH3↑+2H2O
CaCl2+2NH3↑+2H2O2mol 2mol
0.2mol n
n=
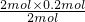 =0.2mol,
=0.2mol,将制得的氨气全部溶于水制成2L溶液,所得氨水物质的量浓度为:c=
 =
=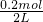 =0.1mol,
=0.1mol,答:(1)NH3的物质的量是0.2mol;(2)所得氨水物质的量浓度为0.1mol/L.
分析:根据n=
 计算10.7g氯化铵的物质的量,反应的化学方程式为2NH4Cl+Ca(OH)2
计算10.7g氯化铵的物质的量,反应的化学方程式为2NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O,根据方程式计算生成的氨气的物质的量,进而计算氨水物质的量浓度.
CaCl2+2NH3↑+2H2O,根据方程式计算生成的氨气的物质的量,进而计算氨水物质的量浓度.点评:本题考查物质的量应用于化学方程式的计算,题目难度不大,注意化学方程式的书写以及物质的量的有关计算公式的运用.

练习册系列答案
相关题目