题目内容
 (2012?绵阳模拟)四种短周期元素在周期表中的相对位置如下图所示,其中W的最外层电子数与质子数之比为3:8.下列叙述不正确的是( )
(2012?绵阳模拟)四种短周期元素在周期表中的相对位置如下图所示,其中W的最外层电子数与质子数之比为3:8.下列叙述不正确的是( )分析:W的最外层电子数与质子数之比为3:8,当最外层电子数为3时,其电子排布为2、6,最外层不是3,不成立,当最外层电子数为6是,其电子排布为2、8、6,为S元素,则Y为O元素,则X为C元素,Z为Si元素.
A、Z与X、Y形成的化合物分别为SiC、SiO2;
B、X与W形成的化合物为CS2,为直线型分子;
C、四种元素的气态氢化物中,W的气态氢化物相对分子质量最大,Y的氢化物为H20,含有氢键;
D、根据非金属性强弱比较酸性强弱.
A、Z与X、Y形成的化合物分别为SiC、SiO2;
B、X与W形成的化合物为CS2,为直线型分子;
C、四种元素的气态氢化物中,W的气态氢化物相对分子质量最大,Y的氢化物为H20,含有氢键;
D、根据非金属性强弱比较酸性强弱.
解答:解:W的最外层电子数与质子数之比为3:8,当最外层电子数为3时,其电子排布为2、6,最外层不是3,不成立,当最外层电子数为6是,其电子排布为2、8、6,为S元素,则Y为O元素,则X为C元素,Z为Si元素:
A、Z与X、Y形成的化合物分别为SiC、SiO2,都是原子晶体,故A正确;
B、X与W形成的化合物为CS2,为直线型分子,分子中正负电荷重心重叠,为非极性分子,故B正确;
C、四种元素的气态氢化物中,W的气态氢化物相对分子质量最大,Y的氢化物为H20,含有氢键,沸点最高,故C错误;
D、X、Z、W三种元素对应的最高价含氧酸分别为H2C03、H2SiO3、H2SO4,其中Si元素非金属性最弱,H2SiO3酸性最弱,故D正确.
故选C.
A、Z与X、Y形成的化合物分别为SiC、SiO2,都是原子晶体,故A正确;
B、X与W形成的化合物为CS2,为直线型分子,分子中正负电荷重心重叠,为非极性分子,故B正确;
C、四种元素的气态氢化物中,W的气态氢化物相对分子质量最大,Y的氢化物为H20,含有氢键,沸点最高,故C错误;
D、X、Z、W三种元素对应的最高价含氧酸分别为H2C03、H2SiO3、H2SO4,其中Si元素非金属性最弱,H2SiO3酸性最弱,故D正确.
故选C.
点评:本题考查位置结构性质的关系即应用,题目难度不大,注意题中晶体类型的判断、熔沸点高低的比较以及酸性强弱的比较等问题.

练习册系列答案
 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案
相关题目
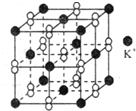 (2012?绵阳模拟)钾在氧气中燃烧时得到一种钾的氧化物晶体,其结构如图所示,下列有关说法正确的是( )
(2012?绵阳模拟)钾在氧气中燃烧时得到一种钾的氧化物晶体,其结构如图所示,下列有关说法正确的是( )