题目内容
200℃时,11.6 g CO2和水蒸气的混合气体与过量的Na2O2充分反应后,固体质量增加了3.6 g,再将反应后剩余固体冷却后加入含有 、
、 、
、 、
、 等离子的水溶液中,若溶液体积保持不变,则下列说法中正确的是 ( )
等离子的水溶液中,若溶液体积保持不变,则下列说法中正确的是 ( )
 、
、 、
、 、
、 等离子的水溶液中,若溶液体积保持不变,则下列说法中正确的是 ( )
等离子的水溶液中,若溶液体积保持不变,则下列说法中正确的是 ( )| A.原混合气体的平均摩尔质量为23.2 g/mol |
| B.混合气体与Na2O2反应过程中电子转移的物质的量为0.25 mol |
C.溶液中 的物质的量浓度基本保持不变 的物质的量浓度基本保持不变 |
D.溶液中 的物质的量浓度减小, 的物质的量浓度减小, 的物质的量浓度增大,但是 的物质的量浓度增大,但是 和 和 的物质的量浓度之和基本保持不变 的物质的量浓度之和基本保持不变 |
A
试题分析:A项:设混合物中CO2和H2O的物质的量分别为m、n
则44m+18n=11.6①
1mol的CO2和1mol的H2O与Na2O2反应,固体质量分别增加(44-16)=28g、(18-16)=2g
所以28m+2n=3.6②
合并①②
解得m=0.1mol n=0.4mol
M(平均)=m(总)/n(总)=11.6g/(0.1mol+0.4mol)= 23.2 g/mol。A正确。
B项:2CO2 + 2Na2O2 = 2Na2CO3 + O2①,2Na2O2+2H2O="==4NaOH+" O2↑②,①中转移电子0.1mol,②中转移电子0.4mol,总转移电子书为0.5mol。B错误。
C、D项:剩余固体加入到溶液中,OH-和HCO3-发生反应,OH-+ HCO3-=CO32-+H2O③,溶液中HCO3-浓度减少,CO32-浓度增加来源2个方面,剩余固体Na2CO3中的和反应③的,
 和
和 的物质的量浓度之和会增大。
的物质的量浓度之和会增大。 水解方程式为,
水解方程式为, +H20
+H20 HSO32-+OH-④,剩余固体NaOH加入到溶液中会有大量的OH-,反应④会逆向移动,
HSO32-+OH-④,剩余固体NaOH加入到溶液中会有大量的OH-,反应④会逆向移动, 浓度会增大。C、D错误。故选A。
浓度会增大。C、D错误。故选A。点评:考查的内容不多但繁琐,过氧化钠的性质,水解反应及其移动都是常考的知识点。

练习册系列答案
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案
相关题目

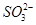 之间发生怎样的反应,请你一起参与并协助他们完成实验。(1)提出猜想:
之间发生怎样的反应,请你一起参与并协助他们完成实验。(1)提出猜想: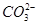 小外,还有_ _______。
小外,还有_ _______。

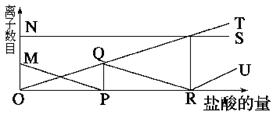
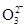 ; OT:HC
; OT:HC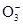 ; RU:Cl-
; RU:Cl-