题目内容
【题目】工业制得的氮化铝(AlN)产品中常含有少量Al4C3、Al2O3、C等杂质。某同学设计了如下实验分别测定氮化铝(AlN)样品中AlN和Al4C3的质量分数(忽略NH3在强碱性溶液中的溶解)。
(1)实验原理:①Al4C3与硫酸反应可生成CH4。
②AlN溶于强酸产生铵盐,溶于强碱生成氨气。
写出Al4C3与硫酸反应的化学方程 。
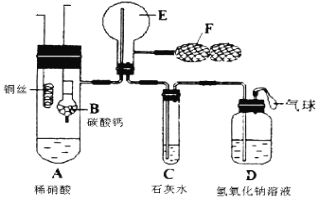
(2)实验装置(如图所示):
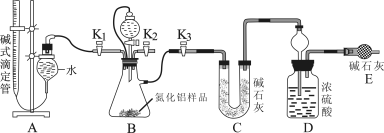
(3)实验过程:
①连接实验装置,检验装置的气密性。称得D装置的质量为yg,滴定管的读数为amL
②称取xgAlN样品置于装置B瓶中;塞好胶塞,关闭活塞K2、K3 ,打开活塞K1,通过分液漏斗加入稀硫酸,与装置B瓶内物质充分反应。
③待反应进行完全后,关闭活塞K1,打开活塞K3 ,通过分液漏斗加入过量NaOH ,与装置B瓶内物质充分反应。
④ (填入该步应进行的操作)。
⑤记录滴定管的读数为bmL,称得D装置的质量为zg。
(4)数据分析:(已知:该实验条件下的气体摩尔体积为Vm L·mol-1)
①Al4C3的质量分数为 。
②若读取滴定管中气体的体积时,液面左高右低,则所测气体的体积 (填“偏大”、“偏小”或“无影响”下同)。若分液漏斗和吸滤瓶间没有用橡胶管连通,则所测气体的体积 。
③AlN的质量分数为 。
【答案】
(1)Al4C3 +6H2SO4==2Al2(SO4)3+3CH4↑
(3)④打开K2通入空气一段时间
(4)① ![]() ;②偏小;偏大;③
;②偏小;偏大;③![]() ×100%
×100%
【解析】
试题分析:(1)Al4C3与硫酸反应的化学方程式为Al4C3 +6H2SO4==2Al2(SO4)3+3CH4↑,故答案为:Al4C3 +6H2SO4=2Al2(SO4)3+3CH4↑;
(3)实验过程:从实验装置和实验步骤上看,本实验的原理是用足量硫酸与样品中Al4C3完全反应,量取生成的甲烷气体,从而可测得Al4C3的百分含量;用足量NaOH溶液与样品中AlN完全反应,充分吸收生成的氨气,并称量其质量,从而求得AlN的质量分数。通过分液漏斗加入稀硫酸,硫酸与样品中Al4C3完全反应,量取生成的甲烷气体,从而测得Al4C3的百分含量,故应关闭活塞K2、K3,打开活塞 K1。用足量NaOH溶液与样品中AlN完全反应,充分吸收生成的氨气,并称量其质量,从而求得AlN的质量分数。故应关闭活塞K1,打开活塞K3由②中分析可知,通过分液漏斗加入过量氢氧化钠溶液,装置中残留部分氨气,打开K2,通入空气一段时间,排尽装置的氨气,被装置D完全吸收,防止测定的氨气的质量偏小,故答案为:打开K2,通入空气一段时间;
(4)数据分析:
①甲烷的体积为(a-b)mL,物质的量为![]() =
=![]() ×10-3mol,根据碳原子的守恒,Al4C3的物质的量等于甲烷的物质的量的三分之一,所以Al4C3的质量为
×10-3mol,根据碳原子的守恒,Al4C3的物质的量等于甲烷的物质的量的三分之一,所以Al4C3的质量为![]() ×
×![]() ×10-3mol×144g/mol=
×10-3mol×144g/mol=![]() ×10-3g,Al4C3的质量分数为
×10-3g,Al4C3的质量分数为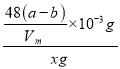 ×100%=
×100%=![]() ×100%.故答案为:
×100%.故答案为:![]() ×100%。
×100%。
②读取滴定管中气体的体积时,液面左高右低,气体的压强大于大气压,测定气体甲烷的体积偏小,若分液漏斗和吸滤瓶间没有用橡胶管连通,则所测气体的的压强小于外界大气压,使得所测气体的体积偏大,故答案为:偏小;偏大;
③氨气的质量为(z-y)g,物质的量为![]() =
=![]() mol,根据氮原子的守恒,氨气的物质的量等于AlN的物质的量,所以AlN的质量为
mol,根据氮原子的守恒,氨气的物质的量等于AlN的物质的量,所以AlN的质量为![]() mol×41g/mol=
mol×41g/mol=![]() g,故AlN的质量分数为
g,故AlN的质量分数为![]() ×100%,故答案为:
×100%,故答案为:![]() ×100%。
×100%。

 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案