题目内容
下列说法中,正确的是
| A.溶于水的强电解质在水中完全电离 |
| B.强电解质在水中溶解度一定大于弱电解质 |
| C.强电解质一定是离子化合物 |
| D.强电解质溶液的导电性一定大于弱电解质 |
A
解析试题分析:强电解质指的是在熔融状态下或水溶液中能完全电离的化合物,完全电离与水中溶解度无关,而导电性与离子浓度有关,如AgCl、BaSO4 等难溶性的物质也是强电解质,溶解度很小,但是溶解的那部分是完全电离的,而且浓度很小导电能力很差,所以B、D错误;强电解质可以是离子化合物也可以是共价化合物如NaCl、HCl等,所以C想错误;故选A。
考点:本题考查的是强电解质的特点。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列离子方程式书写正确的是( )
| A.向氯化铝溶液中加入过量的氨水:3NH3?H2O+Al3+=3NH4++ Al(OH)3↓ |
| B.NaOH溶液吸收少量CO2:OH-+CO2=HCO3- |
| C.向氯化铁溶液中加入铜粉发生的反应:Cu+Fe3+= Cu2+ +Fe2+ |
| D.氯气与水的反应:Cl2+H2O=ClO-+Cl-+ 2H+ |
下列分子或离子在指定的溶液中一定能大量存在的是
| A.常温下呈中性的溶液:Fe3+、Na+、Cl-、SO42- |
| B.1 mol/L的NaAlO2溶液:NH3?H2O、CO32-、K+、SiO32- |
| C.与铝单质反应产生氢气的溶液: Na+、K+、NO3-、Mg2+ |
| D.由水电离出的c(H+)=1×10-12mol/L溶液:HCO3-、NO3-、Na+、Mg2+ |
某澄清透明溶液中只可能含有①Al3+;② Mg2+;③Fe3+;④Fe2+;⑤H+;⑥CO32+;⑦NO3-中的几种,向该溶液中逐滴加入NaOH溶液至过量,生成沉淀的质量与NaOH的物质的量的关系如图所示。则该溶液中一定含有的离子是:( )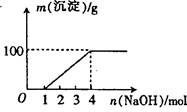
| A.②⑤⑥⑦ | B.②③⑤⑦ |
| C.①②③⑥⑦ | D.①②③④⑤⑦ |
在指定条件下,下列各组离子一定能大量共存的是( )
| A.滴加甲基橙试剂显红色的溶液中:Na+、Fe2+、Cl-、NO3- |
| B.滴入KSCN显血红色的溶液中:NH4+、Mg2+、SO42-、Cl- |
| C.c(OH-)/ c(H+)=1012的溶液中:NH4+、Al3+、NO3-、CO32- |
| D.由水电离的c(H+)=1.0×10-13 mol·L-1的溶液中:K+、NH4+、AlO2-、HCO3- |
甲、乙、丙、丁是由H+、Na+、Al3+、Ba2+、OH—、Cl—、HCO3—离子中的两种组成,可以发生如图转化,下列说法正确的是
| A.甲为AlCl3,乙为NaHCO3 |
| B.溶液丙中还可以大量共存的离子有:Fe2+、NO3—、SO42— |
| C.在甲中滴加丁开始反应的离子方程式:HCO3—+ Ba2++OH—= BaCO3↓+ H2O。 |
| D.白色沉淀A可能溶解在溶液D中。 |
能正确表示下列反应的离子反应方程式为( )
| A.明矾溶于水产生Al(OH)3胶体:Al3++3H2O=Al(OH)3↓+3H+ |
| B.NH4HCO3溶于过量的浓KOH溶液中: NH4++ HCO3-+2OH-= CO32-+ NH3↑+2 H2O |
| C.向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全: 2Al3++3SO42-+3Ba2++6OH -="2" Al(OH)3↓+3BaSO4↓ |
| D.醋酸除去水垢:2H++CaCO3=Ca2++ CO2↑+ H2O |
下列关于电解质、非电解质的说法正确的是
| A.氯气溶于水得氯水,该溶液能导电,因此氯气是电解质 |
| B.CaCO3饱和溶液导电能力很弱,故CaCO3是弱电解质 |
| C.导电能力弱的溶液肯定是弱电解质的溶液 |
| D.HF的水溶液中既有H+、F-,又有大量的HF分子,因此HF是弱电解质 |
下列离子方程式正确的是
| A.澄清的石灰水与稀盐酸反应Ca(OH)2+2H+=Ca2++2H2O |
| B.钠与水的反应Na+2H2O=Na++2OH-+ H2 ↑ |
| C.硫酸氢钠溶液与少量氢氧化钡溶液混合:2H++SO42-+ Ba2++2OH-= BaSO4↓+2H2O |
D.向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O Fe(OH)3↓+3H+ Fe(OH)3↓+3H+ |