题目内容
6.NA代表阿伏加德罗常数的值,下列有关叙述正确的是( )| A. | 30g乙烷中含有共价键的数目为7NA | |
| B. | 1L1mol/L的稀硫酸中,氧原子数为4NA | |
| C. | 标准状况下,11.2LCCl4所含的分子数为0.5NA | |
| D. | 制取84消毒液(NaClO)时,当消耗0.5mol氯气时转移的电子数为NA |
分析 A、30g乙烷的物质的量n=$\frac{30g}{30g/mol}$=1mol,1mol乙烷分子中含共价键数=1mol×(2-1+6)×NA/mol=7NA;
B、稀硫酸溶液中的H2O分子也含有氧原子;
C、标准状况下,CCl4是液体,不能用22.4L/mol来计算;
D、制取84消毒液(NaClO)时,当消耗0.5mol氯气时转移的电子数为0.5NA.
解答 解:A、30g乙烷的物质的量n=$\frac{30g}{30g/mol}$=1mol,1mol乙烷分子中含共价键数=1mol×(2-1+6)×NA/mol=7NA,故A正确;
B、稀硫酸溶液中的H2O分子也含有氧原子,故B错误;
C、标准状况下,CCl4是液体,不能用22.4L/mol来计算,故C错误;
D、制取84消毒液(NaClO)时,当消耗0.5mol氯气时转移的电子数为0.5NA,故D错误;
故选A.
点评 本题考查了阿伏伽德罗常数的应用,主要是化学方程式的过量计算判断,氧化还原反应的电子转移计算,物质的量计算微粒数,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
11.要鉴别己烯中是否混有少量甲苯,正确的实验方法是( )
| A. | 先加足量溴水,然后再加入酸性高锰酸钾溶液 | |
| B. | 先加足量的酸性高锰酸钾溶液,然后再加入溴水 | |
| C. | 点燃这种液体,然后再观察火焰的颜色 | |
| D. | 加入浓硝酸后加热 |
12.下列说法正确的是( )
| A. | 等体积、等物质的量浓度的NH3•H20溶液与NH4C1溶液混合后溶液呈碱性,说明 NH3•H20的电离程度小于NH4+的水解程度 | |
| B. | Si02(s)+2C(s)═Si(s)+2CO(g)在常温下不能自发进行,则该反应的△H>0 | |
| C. | 锅炉内壁上沉积的CaS04可先用饱和Na2C03溶液浸泡,再将不溶物用稀盐酸溶解除去 | |
| D. | 加热O.lmol•L-1Al2(SO4)3溶液,水解程度和溶液的pH均增大 |
9.下列装置属于原电池的是( )
| A. |  CuSO4溶液 | B. | 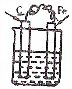 CuSO4溶液 | C. | 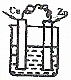 H2SO4 | D. | 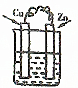 酒精 |
1.下表是元素周期表的一部分,针对表中的①~⑨种元素,填写下列空白:
(1)在这些元素中,化学性质最不活泼的是:Ar(填具体元素符号,下同).
(2)最高价氧化物是两性氧化物的元素是Al;写出它的氧化物与氢氧化钠反应的离子方程式Al2O3+2OH-═2AlO2-+H2O.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
(2)最高价氧化物是两性氧化物的元素是Al;写出它的氧化物与氢氧化钠反应的离子方程式Al2O3+2OH-═2AlO2-+H2O.
11.下列有关物质检验的实验及结论不正确的是( )
| 选项 | 实验操作及现象 | 实验结论 |
| A | 食醋浸泡水垢产生无色气体 | 乙酸的酸性比碳酸强 |
| B | 乙醇与橙色酸性重铬酸钾溶液混合,橙色溶液变为绿色 | 乙醇具有还原性 |
| C | 用铝制容器保存浓硝酸 | 浓硝酸与铝不发生化学反应 |
| D | 碘酒滴到土豆片上变蓝 | 淀粉遇碘单质变蓝 |
| A. | A | B. | B | C. | C | D. | D |
18.能够鉴别乙酸溶液、葡萄糖溶液、酒精溶液的试剂是( )
| A. | 稀盐酸 | B. | NaOH溶液 | C. | 新制Cu(OH)2悬浊液 | D. | Na2CO3溶液 |
15.下列混合物能用分液法分离的是( )
| A. | 乙醇与乙酸 | B. | 乙酸乙酯和Na2CO3溶液 | ||
| C. | 苯和四氯化碳 | D. | 汽油和柴油 |