题目内容
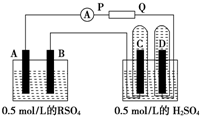
某同学设计了如图所示的装置进行电化学实验,请你根据装置图回答相关问题:
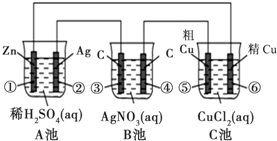
(1)C池属于什么装置______.
(2)电极②上发生电极反应式为______;B池中发生的总反应方程式为______.
(3)反应进行一段时间后,A、B、C三池中电解质溶液浓度基本不变的是______.
(4)当电路上有0.2mol电子流过时,电极④上质量变化______g,电极⑥上质量变化______g.

(1)C池属于什么装置______.
(2)电极②上发生电极反应式为______;B池中发生的总反应方程式为______.
(3)反应进行一段时间后,A、B、C三池中电解质溶液浓度基本不变的是______.
(4)当电路上有0.2mol电子流过时,电极④上质量变化______g,电极⑥上质量变化______g.
依据电极材料分析A池为原电池做电源,所以B池、C池是电解池,原电池中活泼金属做负极,锌做负极发生氧化反应,电极反应为:Zn-2e-=Zn2+,银做正极发生还原反应,溶液中氢离子得到电子生成氢气,电极反应为:2H++2e-=H2↑;B池是惰性电极滴加硝酸银溶液;C池是粗铜做阳极,精铜做阴极是粗铜精炼的反应原理,阳极电极反应电子守恒分别计算电极上质量变化;
(1)分析可知C池是粗铜做阳极,精铜做阴极是粗铜精炼的反应原理,属于电解精炼铜,
故答案为:电解精炼铜;
(2)电极材料分析A池为原电池做电源,所以B池、C池是电解池,原电池中活泼金属做负极,锌做负极发生氧化反应,电极反应为:Zn-2e-=Zn2+,银做正极发生还原反应,溶液中氢离子得到电子生成氢气,电极反应为:2H++2e-=H2↑;B池是惰性电极滴加硝酸银溶液,电池反应为:4AgNO3+2H2O
4Ag+4HNO3+O2↑,
故答案为:2H++2e-=H2↑;4AgNO3+2H2O
4Ag+4HNO3+O2↑;
(3)反应进行一段时间后,A、B、C三池中电解质溶液浓度基本不变的是C池,阳极铜失电子生成铜离子,阴极是溶液中铜离子得到电子生成铜,
故答案为:C池;
(4)当电路上有0.2mol电子流过时,电极④的电极反应为Ag++e-=Ag,电极上质量变化是增加银的质量=0.2mol×108g/mol=21.6g;电极⑥为电解池的阴极,电极反应为Cu2++2e-=Cu,电极上质量变化是增加析出铜的质量=0.1mol×64g/mol=6.4g,
故答案为:21.6;6.4.
(1)分析可知C池是粗铜做阳极,精铜做阴极是粗铜精炼的反应原理,属于电解精炼铜,
故答案为:电解精炼铜;
(2)电极材料分析A池为原电池做电源,所以B池、C池是电解池,原电池中活泼金属做负极,锌做负极发生氧化反应,电极反应为:Zn-2e-=Zn2+,银做正极发生还原反应,溶液中氢离子得到电子生成氢气,电极反应为:2H++2e-=H2↑;B池是惰性电极滴加硝酸银溶液,电池反应为:4AgNO3+2H2O
| ||
故答案为:2H++2e-=H2↑;4AgNO3+2H2O
| ||
(3)反应进行一段时间后,A、B、C三池中电解质溶液浓度基本不变的是C池,阳极铜失电子生成铜离子,阴极是溶液中铜离子得到电子生成铜,
故答案为:C池;
(4)当电路上有0.2mol电子流过时,电极④的电极反应为Ag++e-=Ag,电极上质量变化是增加银的质量=0.2mol×108g/mol=21.6g;电极⑥为电解池的阴极,电极反应为Cu2++2e-=Cu,电极上质量变化是增加析出铜的质量=0.1mol×64g/mol=6.4g,
故答案为:21.6;6.4.

练习册系列答案
 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案
相关题目