题目内容
将4.42g复盐CuSO4?x(NH4)2SO4?yH2O加到过量NaOH溶液中,加热,生成的气体用100mL 1mol?L-1 H2SO4吸收,多余的H2SO4用80mL 2mol?L-1 NaOH恰好完全中和,另取等质量的复盐溶于水后与足量BaCl2溶液反应,生成6.99g沉淀,求x、y的值.分析:根据生成的白色沉淀为硫酸钡,计算出4.42g复盐中含有的硫酸根离子的物质的量,然后根据4.42g复盐分解生成的氨气的物质的量计算出铵离子的物质的量,从而计算出铵离子与硫酸根离子数目之比;再根据计算出的x与计算出复盐的物质的量及y.
解答:解:该复盐与足量BaCl2溶液反应生成的6.99g沉淀为硫酸钡,n(BaSO4)=
=0.03mol;
硫酸中氢离子的物质的量为:n(H+)=1mol?L-1×0.1L×2=0.2mol,氢氧化钠中和的硫酸中氢离子的物质的量为:2mol?L-1×0.08L=0.16mol,
与NH3反应的H+的物质的量为:0.2mol-0.16mol=0.04mol,
由于n(SO42-)=n(BaSO4)=0.03mol,
所以:n(NH4+):n(SO42-)=0.04:0.03=4:3,
即:2x:(x+1)=4:3,
解得:x=2,复盐的化学式为CuSO4?2(NH4)2SO4?yH2O,根据硫酸根离子的物质的量可知,4.42g该复盐的物质的量为:
mol=0.01mol,
所以该复盐的摩尔质量为:M(复盐)=4.42g÷0.01mol=442g?mol-1,
所以18y+64+96×3+18×4=442,解得:y=1,
答:该复盐中x、y分别为2、3.
| 6.99g |
| 233g/mol |
硫酸中氢离子的物质的量为:n(H+)=1mol?L-1×0.1L×2=0.2mol,氢氧化钠中和的硫酸中氢离子的物质的量为:2mol?L-1×0.08L=0.16mol,
与NH3反应的H+的物质的量为:0.2mol-0.16mol=0.04mol,
由于n(SO42-)=n(BaSO4)=0.03mol,
所以:n(NH4+):n(SO42-)=0.04:0.03=4:3,
即:2x:(x+1)=4:3,
解得:x=2,复盐的化学式为CuSO4?2(NH4)2SO4?yH2O,根据硫酸根离子的物质的量可知,4.42g该复盐的物质的量为:
| 0.03 |
| 2+1 |
所以该复盐的摩尔质量为:M(复盐)=4.42g÷0.01mol=442g?mol-1,
所以18y+64+96×3+18×4=442,解得:y=1,
答:该复盐中x、y分别为2、3.
点评:本题考查复盐化学式的确定,题目难度中等,注意掌握复杂化学式的方法,能够根据沉淀的质量、中和反应数据计算出铵根离子与硫酸根离子的物质的量是解题关键.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
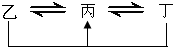 元素A、B、C、D、E、F是位于元素周期表前四周期元素,且原子序数依次增大.其中 D、F为常见金属元素;A元素原子核内只有一个质子,元素A与B形成的气态化合物甲在标准状况下的密度为0.759g?L-1,C元素原子的最外层电子数是其电子层数的3倍,E与C同主族,由D或F元素组成的单质或某些离子(或化合物)在溶液中均有下列转化关系(其它参与反应的物质未列出):其中,均含D元素的乙、丙、丁微粒间的转化全为非氧化还原反应;均含F元素的乙、丙、丁微粒间的转化全为氧化还原反应;相邻的乙与丙或丙与丁两两间均互不发生化学反应.请回答下列问题:
元素A、B、C、D、E、F是位于元素周期表前四周期元素,且原子序数依次增大.其中 D、F为常见金属元素;A元素原子核内只有一个质子,元素A与B形成的气态化合物甲在标准状况下的密度为0.759g?L-1,C元素原子的最外层电子数是其电子层数的3倍,E与C同主族,由D或F元素组成的单质或某些离子(或化合物)在溶液中均有下列转化关系(其它参与反应的物质未列出):其中,均含D元素的乙、丙、丁微粒间的转化全为非氧化还原反应;均含F元素的乙、丙、丁微粒间的转化全为氧化还原反应;相邻的乙与丙或丙与丁两两间均互不发生化学反应.请回答下列问题:
