题目内容
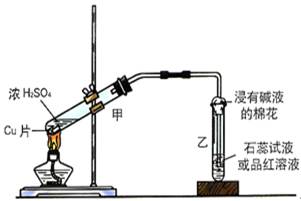
(13分)某研究性学习小组查阅资料得知:漂白粉与硫酸溶液反应可制取氯气,化学方程式为:Ca(C1O)2+CaCl2+H2SO4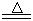 2CaSO4+2Cl2↑+2H2O,该组学生针对上述反应设计如下装置来制取氯气并验证其性质。
2CaSO4+2Cl2↑+2H2O,该组学生针对上述反应设计如下装置来制取氯气并验证其性质。

试回答下列问题:
(1)每生成1 mol Cl2,上述化学反应中转移的电子个数为______ (NA表示阿伏加德罗常数)。
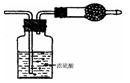
(2)该实验中A处可选用装置__________ _____ (填写装置的序号)。

(3)装置B中发生反应的离子方程式为________________________________________。
(4)装置C中的现象为___________________________________________________,
试结合反应方程式解释其原因 __________________________________ _
_________________________________ 。
(5)装置E中的试剂是______________(任填一种合适试剂的名称),其作用是________
_______________________________ ______。
(6)请帮助该学习小组同学设计一个实验,证明装置D中有FeCl3生成(请简述实验 步骤)
步骤)
_________________________________________________________________________
_________________________ __________________________ ______________
__________________________ ______________
 2CaSO4+2Cl2↑+2H2O,该组学生针对上述反应设计如下装置来制取氯气并验证其性质。
2CaSO4+2Cl2↑+2H2O,该组学生针对上述反应设计如下装置来制取氯气并验证其性质。
试回答下列问题:
(1)每生成1 mol Cl2,上述化学反应中转移的电子个数为______ (NA表示阿伏加德罗常数)。
(2)该实验中A处可选用装置__________ _____ (填写装置的序号)。

(3)装置B中发生反应的离子方程式为________________________________________。
(4)装置C中的现象为___________________________________________________,
试结合反应方程式解释其原因 __________________________________ _
_________________________________ 。
(5)装置E中的试剂是______________(任填一种合适试剂的名称),其作用是________
_______________________________ ______。
(6)请帮助该学习小组同学设计一个实验,证明装置D中有FeCl3生成(请简述实验
 步骤)
步骤)_________________________________________________________________________
_________________________
 __________________________ ______________
__________________________ ______________(13分) (1) NA (2分)
 (2) ② (1分) (3) Cl2+2I-=I2+2Cl- (2分)
(2) ② (1分) (3) Cl2+2I-=I2+2Cl- (2分)
(4)紫色石蕊试液先变红后褪色(1分) Cl2通入石蕊试液中发生反应Cl2+H2O=HC1+HC1O ,H+使石蕊试液变红,又因为HC1O具有强氧化性,使红色褪去(2分)
(5)氢氧化钠溶液(1分) 吸收多余的氯气,防止污染空气(2分)
吸收多余的氯气,防止污染空气(2分)
(6)取装置D中的溶液于一支洁净试管中,滴加适量的KSCN溶液,溶液变成血红色,则证明有FeCl3生成(2分)

 (2) ② (1分) (3) Cl2+2I-=I2+2Cl- (2分)
(2) ② (1分) (3) Cl2+2I-=I2+2Cl- (2分)(4)紫色石蕊试液先变红后褪色(1分) Cl2通入石蕊试液中发生反应Cl2+H2O=HC1+HC1O ,H+使石蕊试液变红,又因为HC1O具有强氧化性,使红色褪去(2分)
(5)氢氧化钠溶液(1分)
 吸收多余的氯气,防止污染空气(2分)
吸收多余的氯气,防止污染空气(2分)(6)取装置D中的溶液于一支洁净试管中,滴加适量的KSCN溶液,溶液变成血红色,则证明有FeCl3生成(2分)
略

练习册系列答案
相关题目




 试剂:①新制Cu(OH)2
试剂:①新制Cu(OH)2  ②碘水 ③浓硝酸
②碘水 ③浓硝酸