题目内容
【题目】(1)H2O的沸点高于H2S是因为________________;H2O分子比H2S分子稳定是因为__________________。
(2)Al和铁红发生铝热反应的化学方程式_________________,该反应的用途是_________________(任写一条)。
【答案】水分子间存在氢键 H-O键键能大于H-S键键能 2Al+Fe2O3![]() Al2O3+2Fe 焊接钢轨(或冶炼高熔点金属)
Al2O3+2Fe 焊接钢轨(或冶炼高熔点金属)
【解析】
(1) H2O分子间含有氢键;键能越大越稳定;
(2) 铁红主要成分是Fe2O3,铝热反应用于焊接钢轨(或冶炼高熔点金属)。
(1) H2O含有氢键,则熔沸点比H2S高;键能越大越稳定,H2O分子比H2S分子稳定是因为H-O键键能大于H-S键键能;
(2)铁红主要成分是Fe2O3,Al和Fe2O3高温条件下发生铝热反应的化学方程式为 ;该反应放出大量热,可用于焊接钢轨(或冶炼高熔点金属)。
;该反应放出大量热,可用于焊接钢轨(或冶炼高熔点金属)。

 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案【题目】在一定条件下,N2O分解的部分实验数据如下( )
反应时间/min | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
c(N2O)/molL-1 | 0.100 | 0.090 | 0.080 | 0.070 | 0.060 | 0.050 | 0.040 | 0.030 | 0.020 | 0.010 | 0.000 |
下图能正确表示该反应有关物理量变化规律的是( )
(注:图中半衰期指任一浓度N2O消耗一半时所需的相应时间,c1、c2均表示N2O初始浓度且c1<c2)
A.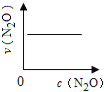 B.
B.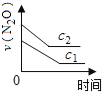 C.
C.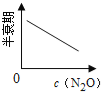 D.
D.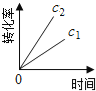
【题目】下列三个化学反应的平衡常数(K1、K2、K3)与温度的关系分别如下表所示:
化学反应 | 平衡常数 | 温度 | |
973K | 1173K | ||
①Fe(s)+CO2(g) | K1 | 1.47 | 2.15 |
②Fe(s)+H2O(g) | K2 | 2.38 | 1.67 |
③CO(g)+H2O(g) | K3 | ? | ? |
则下列说法正确的是
A.△H1<0,△H2>0
B.反应①②③的反应热满足关系:△H2-△H1=△H3
C.反应①②③的平衡常数满足关系:K1·K2=K3
D.要使反应③在一定条件下建立的平衡向正反应方向移动,可采取升温措施