题目内容
(7分)合成氨工厂通常测定反应前后混合气体的密度来确定氮气的转化率。某工厂测得进入合成塔的N2和H2混合气体的密度为0.553 6 g·L-1(标准状况),从合成塔出来的混合气体在相同条件下的密度为0.693 g·L-1。求该合成氨厂N2的转化率。
设N2和H2起始时的总量为1 mol,其中N2的物质的量为x,H2有1 mol-x,则有28 g·mol-1·x+2 g·mol-1(1 mol-x)="0.5536" g·L-1×22.4 L。解之得x="0.4" L,即起始时N2有0.4 mol,H2有0.6 mol。
设0.4 mol N2中转化为NH3的物质的量为y。
N2 + 3H2 2NH3
2NH3
起始量 0.4 mol 0.6 mol 0
变化量 y 3y 2y
平衡量 0.4 mol-y 0.6 mol-3y 2y
平衡时,平衡混合气体总量为:
n(总)="0.4" mol-y+0.6 mol-3y+2y="1" mol-2y
根据质量守恒定律得:1 mol×0.553 6 g·L-1×22.4 L·mol-1="(1" mol-2y)×0.693 g·L-1×22.4 L·mol-1
解之得:y="0.1" mol,所以N2的转化率为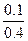 ×100%=25%。
×100%=25%。
设0.4 mol N2中转化为NH3的物质的量为y。
N2 + 3H2
 2NH3
2NH3起始量 0.4 mol 0.6 mol 0
变化量 y 3y 2y
平衡量 0.4 mol-y 0.6 mol-3y 2y
平衡时,平衡混合气体总量为:
n(总)="0.4" mol-y+0.6 mol-3y+2y="1" mol-2y
根据质量守恒定律得:1 mol×0.553 6 g·L-1×22.4 L·mol-1="(1" mol-2y)×0.693 g·L-1×22.4 L·mol-1
解之得:y="0.1" mol,所以N2的转化率为
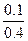 ×100%=25%。
×100%=25%。根据混合气体的密度,可求出其平均相对分子质量,即能求出各组分的体积比,也可根据各组分的体积而求出其平均相对分子质量。

练习册系列答案
 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案
相关题目
 N2O4(g)
N2O4(g) 3C(g),按体积比为A∶B=5∶2将A和B充入到一定容积的密闭容器中,若在恒温条件下达到平衡时C占总体积的60%,设A,B,C的相对分子质量分别用a,b,c表示。试求:
3C(g),按体积比为A∶B=5∶2将A和B充入到一定容积的密闭容器中,若在恒温条件下达到平衡时C占总体积的60%,设A,B,C的相对分子质量分别用a,b,c表示。试求: 2SO3中,增加O2可提高SO2的转化率
2SO3中,增加O2可提高SO2的转化率
 2NH3(g),恒容充入He,N2的转化率与时间的关系
2NH3(g),恒容充入He,N2的转化率与时间的关系