题目内容
已知气态氯化铝分子以双聚形式存在,其结构式如下图所示:
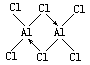
图中“Cl→Al”表示Cl原子提供了一对电子与Al原子共享,又已知硼酸H3BO3为白色固体,溶于水显弱酸性,但它却只是一元酸。可以用硼酸在水溶液中的电离平衡解释它只是一元酸的原因。请写出下面这个方程式右端的两种离子的表达式:
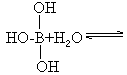 ______+______
______+______

图中“Cl→Al”表示Cl原子提供了一对电子与Al原子共享,又已知硼酸H3BO3为白色固体,溶于水显弱酸性,但它却只是一元酸。可以用硼酸在水溶液中的电离平衡解释它只是一元酸的原因。请写出下面这个方程式右端的两种离子的表达式:
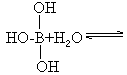 ______+______
______+______
题中给出的信息说明,在氯化铝双聚分子中,铝原子除了与3个氯原子形成共价键外,还能接受另一氯原子提供的孤对电子而形成配位键。硼元素与铬元素同一主族,核外电子排布与原子相似,因而硼酸分子中的硼原子也能接受另外原子提供的孤对电子而形成配位键。由于水分子中的氧原子也有孤对电子,当硼酸与水分子接触后,水分子中的氧原子就会把孤对电子提供出来与B形成配位键。此时水分子中的一个氢仍与氧原子相连,还有一个氢就以离子形式电离出来,即:

因此,硼酸是一元酸,它电离出的H+实际上来源于水,而不是它本身。否则它的三个性质等同的-OH均应该发生电离,那硼酸就是三元酸。

因此,硼酸是一元酸,它电离出的H+实际上来源于水,而不是它本身。否则它的三个性质等同的-OH均应该发生电离,那硼酸就是三元酸。

练习册系列答案
 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案
相关题目
 D:_________________________________。
D:_________________________________。 A:_________________________________。
A:_________________________________。