题目内容
19.下列属于电解质的是( )| A. | NH4Cl、HCl、NaOH、Cu | |
| B. | NaHCO3、液态H2SO4、Ba(OH)2、BaSO4液体 | |
| C. | 液氧、稀H2SO4、BaCl2、HNO3 | |
| D. | 酒精CO2、NH3、CH4 |
分析 电解质是在水溶液中或熔融状态下能导电的化合物,据此分析.
解答 解:A、Cu是单质,既不是电解质也不是非电解质,故A错误;
B、NaHCO3、液态H2SO4、Ba(OH)2在溶于水后导电,故为电解质;BaSO4液体能导电,故为电解质,故B正确;
C、液氧是单质,既不是电解质也不是非电解质;稀硫酸是混合物,既不是电解质也不是非电解质,故C错误;
D、酒精在水溶液中和熔融状态下均不能导电,故为非电解质;CO2、NH3在水溶液中导电和其本身无关,在熔融状态下不能导电,故为非电解质;甲烷难溶于水,在熔融状态下也不导电,故为非电解质,故D错误.
故选B.
点评 本题考查了电解质的判断,应注意的是电解质必须是化合物,单质和混合物既不是电解质也不是非电解质,难度不大.

练习册系列答案
相关题目
9.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 6g冰醋酸所含σ键数目为0.7NA | |
| B. | 1L 0.2mol/L的硫酸铝溶液中铝离子的物质的量为0.4NA | |
| C. | 6.72 LNO2和足量水完全反应,转移电子数是2NA | |
| D. | 标准状况下,11.2LN2和33.6LH2混合反应后可生成标况下的氨气22.4L |
10.已知 I-、Fe2+、SO2、Cl-和H2O2均有还原性,它们在酸性溶液中还原性的强弱顺序为Cl-<H2O2<Fe2+<I-<SO2,则下列反应不能发生的是( )
| A. | 2Fe3++SO2+2H2O=2Fe2++SO42-+4H+ | B. | I2+SO2+2H2O=H2SO4+2HI | ||
| C. | 2Fe3++2I-=2Fe2++I2 | D. | H2O2+H2SO4=SO2+O2+2H2O |
7.要从苯酚的乙醇溶液中回收苯酚,下列合理的操作步骤顺序是( )
①蒸馏
②过滤
③静置分液
④加足量钠
⑤通入过量CO2
⑥加入足量NaOH溶液
⑦加入乙酸和浓硫酸的混合液后加热
⑧加入浓溴水
⑨加足量的FeCl3溶液
⑩加热.
①蒸馏
②过滤
③静置分液
④加足量钠
⑤通入过量CO2
⑥加入足量NaOH溶液
⑦加入乙酸和浓硫酸的混合液后加热
⑧加入浓溴水
⑨加足量的FeCl3溶液
⑩加热.
| A. | ④⑤⑩ | B. | ⑥①⑤③ | C. | ⑨②⑧① | D. | ⑦①③⑩ |
14.下列有关SO2的性质的探究实验报告记录的实验现象正确的是( )
| 实验 | 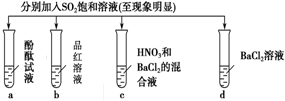 | ||||
| 记录 | A | 无色 | 无色 | 无现象 | 无色溶液 |
| B | 红色 | 无色 | 白色沉淀 | 白色溶液 | |
| C | 无色 | 无色 | 白色沉淀 | 无色溶液 | |
| D | 红色 | 无色 | 白色沉淀 | 白色溶液 | |
| A. | A | B. | B | C. | C | D. | D |
4. 用如图所示装置分别进行如下实验,测定溶液导电性变化.以下哪个选项为导电性先增大后减弱的为( )
用如图所示装置分别进行如下实验,测定溶液导电性变化.以下哪个选项为导电性先增大后减弱的为( )
 用如图所示装置分别进行如下实验,测定溶液导电性变化.以下哪个选项为导电性先增大后减弱的为( )
用如图所示装置分别进行如下实验,测定溶液导电性变化.以下哪个选项为导电性先增大后减弱的为( )| A. | 向醋酸溶液中加入氨水 | B. | 向AgNO3溶液中加入HCl | ||
| C. | 向盐酸溶液中加入NaCl溶液 | D. | 向H2SO4溶液中加入BaCl2溶液 |
8.现有部分短周期元素的性质或原子结构如表:
(1)写出元素X电子排布式1s22s22p4.
(2)Z原子共有7种运动状态不同的电子.
(3)写出Z元素形成的单质的结构式:N≡N.
(4)元素T与氯元素相比,非金属性较强的是F(用元素符号表示),下列表述 中能证明这一事实的是C
A、常温下氯气的颜色比T单质的颜色深
B、T的单质通入氯化钠水溶液不能置换出氯气
C、氯与T形成的化合物中氯元素呈正价态
(5)探寻物质的性质差异性是学习的重要方法之-.T、X、Y、Z四种元素的单质中化学性质明显不同于其他三种单质的是Al(填化学式),理由铝是金属单质,其它的是非金属单质.
(6)T与Z形成的化合物含有的化学键类型共价键.
| 元素编号 | 元素性质或原子结构 |
| T | 所有元素中电负性最大的元素 |
| X | L层p电子数比s电子数多2个 |
| Y | 其最高价氧化物呈两性 |
| Z | L层有三个未成对电子 |
(2)Z原子共有7种运动状态不同的电子.
(3)写出Z元素形成的单质的结构式:N≡N.
(4)元素T与氯元素相比,非金属性较强的是F(用元素符号表示),下列表述 中能证明这一事实的是C
A、常温下氯气的颜色比T单质的颜色深
B、T的单质通入氯化钠水溶液不能置换出氯气
C、氯与T形成的化合物中氯元素呈正价态
(5)探寻物质的性质差异性是学习的重要方法之-.T、X、Y、Z四种元素的单质中化学性质明显不同于其他三种单质的是Al(填化学式),理由铝是金属单质,其它的是非金属单质.
(6)T与Z形成的化合物含有的化学键类型共价键.