题目内容
【题目】T℃时,在容积为0.5L的密闭容器中发生某一反应,且测得不同时间容器中四种物质A、B、C、D的物质的量变化如图所示. 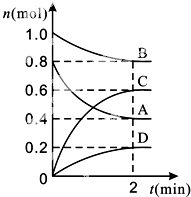
已知:物质A、B、C均为气态、D为固态,正反应是吸热反应.根据要求回答下列问题:
(1)容器中反应的化学方程式为 .
(2)前2min,v(A)=mol(minL)﹣1 .
(3)能说明该反应已达到平衡状态的是 .
A.混合气体的压强不变
B.混合气体的密度不变
C.消耗0.1mol的B同时生成0.1mol的D
D.B的物质的量不变
(4)T℃时,该反应的平衡常数K=(保留小数点后两位). 反应达到平衡后,只增加B的物质的量,则平衡移动方向为;平衡常数K(填增大.减小或不变).
(5)反应达到平衡后,改变下列措施能使A的转化率增大的是 (填选项字母).
A.只增加A的物质的量
B.移走一部分D
C.升高反应体系的温度
D.把容器的体积缩小一倍
(6)T℃时,容积为1L的密闭容器中,起始时充入0.2mol A、0.4mol B、0.3mol C、0.5mol D,此时v(正)v(逆) (填“>”“<”或“=”).
【答案】
(1)2A+B?3C+D
(2)0.4
(3)BD
(4)1.69;正向;不变
(5)C
(6)=
【解析】解:(1)A、B的物质的量减少,为反应物;C、D的物质的量增加,为生成物,达到平衡时,△n(A)=0.8mol﹣0.4mol=0.4mol,△n(B)=1mol﹣0.0mol=0.2mol,△n(C)=0.6mol,△n(D)=0.2mol,则A、B、C、D的化学计量数之比为0.4:0.2:0.6:0.2=2:1:3:1,故反应的化学方程式为:2A+B3C+D,
故答案为:2A+B3C+D;(2)前2 min,n(A)=0.8mol﹣0.4mol=0.4mol,则v(A)= ![]() =0.4mol(minL)﹣1,
=0.4mol(minL)﹣1,
故答案为:0.4;(3)A.反应前后混合气体物质的量不变,恒温恒容下,混合气体的压强始终不变,故A错误;
B.D为固体,混合气体总质量不变时,说明各组分物质的量不变,反应达到平衡状态,故B正确;
C.消耗0.1mol的B同时生成0.1mol的D,均表示正反应速率,反应始终按该比例关系进行,故C错误,
D.可逆反应得到平衡时,各组分的物质的量不变,B的物质的量不变说明反应到达平衡,故D正确,
故选:BD;(4)平衡时A为0.4mol、B为0.8mol、C为0.6mol,反应前后气体的物质的量不变,可以用物质的量代替浓度计算平衡常数,则K= ![]() =
= ![]() =1.69,
=1.69,
反应达到平衡后,只增加B的物质的量,则平衡正向移动,温度不变,化学平衡常数不变,故答案为:1.69;正向;不变;(5)A.只增加A的物质的量,平衡虽然正向移动,但A的转化率减小,故A错误;
B.D为固体,移走一部分D,不影响平衡移动,故B错误;
C.正反应为吸热反应,升高反应体系的温度,平衡正向移动,A的转化率增大,故C正确;
D.把容器的体积缩小一倍,压强增大,反应前后气体体积不变,平衡不移动,故D错误,
故选:C;(6)此时浓度商Qc= ![]() =1.69=K=1.69,故反应达到平衡状态,则v(正)=v(逆),
=1.69=K=1.69,故反应达到平衡状态,则v(正)=v(逆),
故答案为:=.
(1)A、B的物质的量减少,为反应物;C、D的物质的量增加,为生成物,达到平衡时A、B、C、D改变的物质的量分别为0.4mol、0.2mol、0.6mol、0.2mol,则A、B、C、D的化学计量数之比0.4:0.2:0.6:0.2=2:1:3:1,据此分析;(2)根据v= ![]() 计算v(A);(3)可逆反应到达平衡时,同种物质的正逆速率相等且保持不变,各组分的浓度、含量保持不变,由此衍生的其它一些量不变,判断平衡的物理量应随反应进行发生变化,该物理量由变化到不再变化说明到达平衡;(4)反应前后气体的物质的量不变,用物质的量代替浓度代入K=
计算v(A);(3)可逆反应到达平衡时,同种物质的正逆速率相等且保持不变,各组分的浓度、含量保持不变,由此衍生的其它一些量不变,判断平衡的物理量应随反应进行发生变化,该物理量由变化到不再变化说明到达平衡;(4)反应前后气体的物质的量不变,用物质的量代替浓度代入K= ![]() 计算平衡常数;(5)正反应为气体体积不变的吸热反应,改变条件使A的转化率增大,应使平衡正向移动,但不能只增大A的浓度,D为固体,D的物质的量变化不影响平衡移动,可以是升高温度、移走C、或增大B的浓度;(6)计算此时浓度商Qc,若Qc=K,处于平衡状态,若Qc<K,反应向正反应进行,若Qc>K,反应向逆反应进行.
计算平衡常数;(5)正反应为气体体积不变的吸热反应,改变条件使A的转化率增大,应使平衡正向移动,但不能只增大A的浓度,D为固体,D的物质的量变化不影响平衡移动,可以是升高温度、移走C、或增大B的浓度;(6)计算此时浓度商Qc,若Qc=K,处于平衡状态,若Qc<K,反应向正反应进行,若Qc>K,反应向逆反应进行.

【题目】下列各组物质不能按![]() “
“![]() ” 表示反应一步完成关系转化的是
” 表示反应一步完成关系转化的是 ![]()
选项 | a | b | c |
A | SiO2 | Na2SiO3 | H2SiO3 |
B | AlCl3 | Al(OH)3 | NaAlO2 |
C | Fe | Fe(OH)3 | Fe2O3 |
D | MgCl2 | Mg(OH)2 | MgO |
A. A B. B C. C D. D