题目内容
Ⅰ.某化学实验小组探究市售食用白醋中醋酸的准确浓度,取25.00mL某品牌食用白醋于烧杯中,稀释并转移至250mL容量瓶中,定容,摇匀。取稀释液25.00mL用浓度为cb mol/L的标准NaOH溶液对其进行滴定。
(1)该小组用酚酞试液作指示剂,判断到达滴定终点的实验现象是: 。
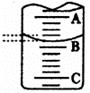
(2)右图表示50mL滴定管中液面的位置,若A与C刻度间相差l mL,A处的刻度为25,滴定管中液面读数应为 mL。
(3)为了减小实验误差,该同学一共进行了三次实验,假设每次所取白醋体积均为25.00mL,NaOH标准液浓度为cb mo1/L,三次实验结果记录如下:
从上表可以看出,第一次实验中记录消耗NaOH溶液的体积明显多于后两次,其原因可能是 。
(4)根据所给数据,写出计算该白醋中醋酸的物质的量浓度的表达式(不必化简):
c= 。
Ⅱ. 用中和滴定法测定NaOH和Na2CO3混合溶液中的NaOH的质量分数时,可先在混合溶液中加入过量的BaCl2溶液,使Na2CO3完全变成BaCO3沉淀,然后用标准盐酸滴定(用酚酞做为指示剂)。试回答:
(1)向混有BaCO3沉淀的NaOH溶液里滴加盐酸,为什么不会使BaCO3溶解而能测定NaOH溶液的质量分数?
(2)分析在滴定过程中不断振荡锥形瓶的原因?
(3)滴定终点时溶液颜色如何变化?
(4)能否改用甲基橙作指示剂?并说明理由。
(1)该小组用酚酞试液作指示剂,判断到达滴定终点的实验现象是: 。
(2)右图表示50mL滴定管中液面的位置,若A与C刻度间相差l mL,A处的刻度为25,滴定管中液面读数应为 mL。

(3)为了减小实验误差,该同学一共进行了三次实验,假设每次所取白醋体积均为25.00mL,NaOH标准液浓度为cb mo1/L,三次实验结果记录如下:
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗NaOH溶液体积/mL | 26.32 | 25.34 | 25.30 |
| A.滴定前滴定管尖嘴有气泡,滴定结束无气泡 |
| B.盛装标准液的滴定管装液前用蒸馏水洗后,未用标准液润洗 |
| C.第一次滴定用的锥形瓶用白醋润洗 |
D.该NaOH标准液保存时间过长,有部分变质,浓 度降低 度降低 |
c= 。
Ⅱ. 用中和滴定法测定NaOH和Na2CO3混合溶液中的NaOH的质量分数时,可先在混合溶液中加入过量的BaCl2溶液,使Na2CO3完全变成BaCO3沉淀,然后用标准盐酸滴定(用酚酞做为指示剂)。试回答:
(1)向混有BaCO3沉淀的NaOH溶液里滴加盐酸,为什么不会使BaCO3溶解而能测定NaOH溶液的质量分数?
(2)分析在滴定过程中不断振荡锥形瓶的原因?
(3)滴定终点时溶液颜色如何变化?
(4)能否改用甲基橙作指示剂?并说明理由。
Ⅰ(1)由无色变粉红色,且半分钟内不褪色 (1分)(2) 25.40 mL(1分)
(3)A、B、C (2分)(4) 253.2cb/25.00 mol/L (2分)
Ⅱ(1)用酚酞作为指示剂,从滴定开始至滴定终点,溶液始终呈现碱性,故BaCO3不会
溶解,滴加的盐酸只与NaOH反应
(2)防止溶液局部酸化使BaCO3溶解
(3)由红色变无色
(4)不能,用甲基橙作指示剂,终点呈酸性,HCl与BaCO3反应,测定结果不准确
(3)A、B、C (2分)(4) 253.2cb/25.00 mol/L (2分)
Ⅱ(1)用酚酞作为指示剂,从滴定开始至滴定终点,溶液始终呈现碱性,故BaCO3不会
溶解,滴加的盐酸只与NaOH反应
(2)防止溶液局部酸化使BaCO3溶解
(3)由红色变无色
(4)不能,用甲基橙作指示剂,终点呈酸性,HCl与BaCO3反应,测定结果不准确
略

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
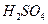 、
、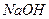 ——腐蚀品
——腐蚀品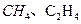 ——易燃液体
——易燃液体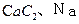 ——遇湿易燃物品
——遇湿易燃物品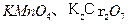 ——氧化剂
——氧化剂 ( )
( )