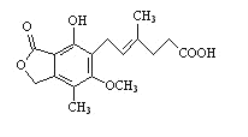
题目内容
【题目】生活污水中的氮和磷主要以铵盐和磷酸盐形式存在,可用电解法从溶液中去除。电解装置如图:

以铁作阴极、石墨作阳极,可进行除氮;翻转电源正负极,以铁作阳极、石墨作阴极,可进行除磷。
I.电解除氮
(1)在碱性溶液中,NH3能直接在电极放电,转化为N2,相应的电极反应式为:_______。
(2)有Cl-存在时,除氮原理如图所示

主要依靠有效氯(HClO、ClO-)将NH4+ 或NH3氧化为N2。在不同pH条件下进行电解时,氮的去除率和水中有效氯浓度如图:

①当pH<8时,主要发生HClO氧化NH4+ 的反应,其离子方程式为:____________。
②结合平衡移动原理解释,当pH<8时,氮的去除率随pH的降低而下降的原因是:_____。
II.电解除磷
(3)除磷的原理是利用Fe2+ 将PO43- 转化为Fe3(PO4)2沉淀。
如图为某含Cl- 污水在氮磷联合脱除过程中溶液pH的变化。推测在20-40 min时脱除的元素是________。

(4)测定污水磷含量的方法如下:取100mL污水,调节至合适pH后用AgNO3溶液使磷全部转化为Ag3PO4沉淀。将沉淀过滤并洗涤后,用硝酸溶解,再使用NH4SCN溶液滴定产生的Ag+,发生反应Ag++SCN-=AgSCN↓,共消耗c mol/LNH4SCN溶液V mL。则此污水中磷的含量为_________mg/L(以磷元素计)。
【答案】2NH3–6e-+6OH-=N2+6H2O 3HClO +2NH4+=3Cl-+N2↑+3H2O+5H+ 随溶液pH降低,c(H+)增大,Cl2 + H2O![]() H+ + Cl- +HClO平衡逆向移动,溶液中c(HClO)减小,使NH4+的氧化率下降 磷
H+ + Cl- +HClO平衡逆向移动,溶液中c(HClO)减小,使NH4+的氧化率下降 磷 ![]()
【解析】
以铁作阴极、石墨作阳极,可进行除氮;翻转电源正负极,以铁作阳极、石墨作阴极,可进行除磷,
Ⅰ.(1)在碱性溶液中,NH3能直接在电极放电,转化为N2,氮元素化合价-3价升高为0价,在阳极发生氧化反应;
(2)①当pH<8时,主要发生HClO氧化NH4+的反应生成氮气,次氯酸被还原为氯离子,结合电子守恒和电荷守恒、原子守恒书写离子反应方程式;
②pH<8时,氮的去除率随pH的降低而下降,是因为氯气和水的反应为可逆反应,PH减小,酸性增加,氢离子浓度增大,平衡逆向进行,次氯酸浓度减小;
Ⅱ.(3)②图象中开始时脱氮,转化电极后是脱磷;
(4)取100mL污水,调节至合适pH后用AgNO3溶液使磷全部转化为Ag3PO4沉淀。将沉淀过滤并洗涤后,用硝酸溶解,再使用NH4SCN溶液滴定产生的Ag+,发生反应Ag++SCN-═AgSCN↓,共消耗cmol/LNH4SCN溶液VmL.反应过程中元素守恒PO43-~Ag3PO4~3AgSCN~3NH4SCN,据此计算。
Ⅰ.(1)在碱性溶液中,NH3能直接在电极放电,转化为N2,氮元素化合价-3价升高为0价,在阳极发生氧化反应,电极反应:2NH3-6e-+6OH-=N2+6H2O;
(2)①当pH<8时,主要发生HClO氧化NH4+的反应生成氮气,次氯酸被还原为氯离子,结合电子守恒和电荷守恒、原子守恒书写离子反应方程式为:3HClO+2NH4+=3Cl-+N2+3H2O+5H+;
②当pH<8时,氮的去除率随pH的降低而下降,结合平衡移动原理解释的原因是:随溶液pH降低,c(H+)增大,Cl2+H2OH++Cl-+HClO平衡逆向移动,溶液中c(HClO)减小,使NH4+的氧化率下降,
故答案为:随溶液pH降低,c(H+)增大,Cl2+H2OH++Cl-+HClO平衡逆向移动,溶液中c(HClO)减小,使NH4+的氧化率下降;
(3)如图为某含Cl-污水在氮磷联合脱除过程中溶液pH的变化,开始时脱氮元素,翻转电极后,在20-40min时脱除的元素是磷,故答案为:磷;
(4)取100mL污水,调节至合适pH后用AgNO3溶液使磷全部转化为Ag3PO4沉淀。将沉淀过滤并洗涤后,用硝酸溶解,再使用NH4SCN溶液滴定产生的Ag+,发生反应Ag++SCN-═AgSCN↓,共消耗cmol/LNH4SCN溶液VmL.反应过程中元素守恒:P~PO43-~Ag3PO4~3AgSCN~3NH4SCN,消耗的NH4SCN物质的量为cmol/L×V×10-3L,则磷原子的物质的量为![]() ×cmol/L×V×10-3L,100mL此污水中磷的质量为
×cmol/L×V×10-3L,100mL此污水中磷的质量为![]() ×cmol/L×V×10-3L×31g/mol=
×cmol/L×V×10-3L×31g/mol=![]() cVmg,1L污水中磷的含量
cVmg,1L污水中磷的含量![]() mg。
mg。

【题目】在100 ℃时,将0.40 mol二氧化氮气体充入一个2 L抽空的密闭容器中,发生反应:2NO2![]() N2O4。每隔一段时间就对该容器内的物质进行分析,得到下表数据:
N2O4。每隔一段时间就对该容器内的物质进行分析,得到下表数据:
时间/s | 0 | 20 | 40 | 60 | 80 |
n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
(1)在上述条件下,从反应开始至20 s时,用二氧化氮表示的平均反应速率为_______mol/(L·s)。
(2)该反应的平衡常数K的数值为____。
(3)若在相同条件下最初向该容器中充入四氧化二氮气体,要达到上述平衡状态,四氧化二氮的起始浓度是______mol·L-1。
(4)达到平衡后,如果升高温度,气体颜色会变深,则升高温度后,反应2NO2![]() N2O4的平衡常数将_________(填“增大”“减小”或“不变”)。
N2O4的平衡常数将_________(填“增大”“减小”或“不变”)。
(5)达到平衡后,如果向该密闭容器中再充入0.32 mol He,并把容器体积扩大为4 L,则平衡将_______(填“向左移动”“向右移动”或“不移动”)。