题目内容
下列反应离子方程式正确的是( )
| A.氨水中中通入过量二氧化硫: 2NH3·H2O + SO2= 2NH4+ + SO32-+ 2H2O |
| B.浓硫酸与Cu片反应中: Cu + SO42-+4H+= Cu2+ + SO2↑+2H2O |
| C.向澄清石灰水中加入少量小苏打溶液:Ca2+ + OH-+ HCO3-=CaCO3↓+ H2O |
| D.溴化亚铁溶液中通入过量氯气:Fe2+ + 2Br- + 2Cl2= Fe3+ + Br2 + 4Cl-氨水 |
C
由于二氧化硫过量,最终生成酸式盐A错。浓硫酸中离子很少,Cu又是固体,一般不改成离子方程式,且反应要加热才进行,B错。小苏打少量,应该考虑其尽量反应完全,而澄清石灰水中的离子过量,可根据HCO3-需要定,一般假设少量为1mol方便书写,C对。由于Fe2+和 Br-都能被Cl2氧化,过量Cl2可将其按组成比1:2被氧化,但是电荷不守恒,D错。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目




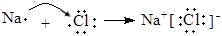
 2CO2 +N2
2CO2 +N2 CH3COO-+NH4++2Ag↓+3NH3+H2O
CH3COO-+NH4++2Ag↓+3NH3+H2O
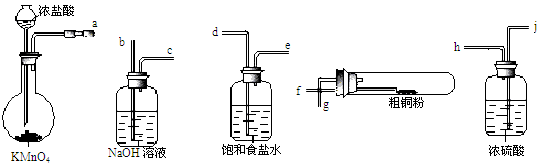
 CuCl42-(aq) + 4 H2O (l)
CuCl42-(aq) + 4 H2O (l)