题目内容
18.Na2CO3溶液中存在水解平衡:CO32-+H2O?HCO3-+OH-.则下列说法正确的是( )| A. | 稀释溶液,溶液pH增大 | B. | 通入CO2,平衡朝正反应方向移动 | ||
| C. | 升高温度,$\frac{{c(HC{O_3}^-)}}{{c(C{O_3}^{2-})}}$减小 | D. | 加入NaOH固体,溶液pH减小 |
分析 A.稀释促进水解,氢氧根离子的物质的量增大,但氢氧根离子浓度减小;
B.通入CO2,发生CO32-+H2O+CO2=2HCO3-;
C.水解为吸热反应;
D.加入NaOH固体,平衡逆向移动,但氢氧根离子的浓度增大.
解答 解:A.稀释促进水解,氢氧根离子的物质的量增大,但氢氧根离子浓度减小,则pH减小,故A错误;
B.通入CO2,发生CO32-+H2O+CO2=2HCO3-,CO32-+H2O?HCO3-+OH-平衡朝正反应方向移动,故B正确;
C.水解为吸热反应,则升高温度,平衡正向移动,可知$\frac{{c(HC{O_3}^-)}}{{c(C{O_3}^{2-})}}$增大,故C错误;
D.加入NaOH固体,平衡逆向移动,但氢氧根离子的浓度增大,则溶液pH增大,故D错误;
故选B.
点评 本题考查影响盐类水解的因素,为高频考点,把握影响水解平衡的因素及pH的计算为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
8.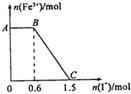 已知酸性K2Cr2O7溶液可与FeSO4反应生成Fe3+和Cr3+.现将硫酸酸化的K2Cr2O7溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如下图所示,下列说法中不正确的是( )
已知酸性K2Cr2O7溶液可与FeSO4反应生成Fe3+和Cr3+.现将硫酸酸化的K2Cr2O7溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如下图所示,下列说法中不正确的是( )
 已知酸性K2Cr2O7溶液可与FeSO4反应生成Fe3+和Cr3+.现将硫酸酸化的K2Cr2O7溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如下图所示,下列说法中不正确的是( )
已知酸性K2Cr2O7溶液可与FeSO4反应生成Fe3+和Cr3+.现将硫酸酸化的K2Cr2O7溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如下图所示,下列说法中不正确的是( )| A. | 图中AB段的氧化剂为K2Cr2O7 | |
| B. | 开始加入的K2Cr2O7为0.25mol | |
| C. | 图中BC段发生的反应为2Fe3++2I-═2Fe2++I2 | |
| D. | K2Cr2O7与FeSO4反应的物质的量之比为1:3 |
9.下列离子方程式正确的是( )
| A. | 氯气和水的反应 Cl2+H2O═2H++Cl-+ClO- | |
| B. | 碳酸氢钠水解 HCO3-+H2O═H3O++CO32- | |
| C. | 碳酸钠水解 CO32-+2H2O═H2CO3+2OH- | |
| D. | 亚硫酸氢钠与过量的Ba(OH)2溶液 HSO3-+Ba2++OH-═BaSO3↓+H2O |
3.1L丁烷与xLO2混合点燃,丁烷完全反应后,生成混合气体体积为aL (气体体积均在120℃、1.01×l05Pa时测定),将a L混合气体通过足量碱石灰后,测得剩余气体体积为b L,若a-b=7,则x的值为( )
| A. | 4 | B. | 4.5 | C. | 5.5 | D. | 6 |
10.以下有机反应类型:①取代反应 ②加成反应 ③消去反应 ④酯化反应 ⑤加聚反应 ⑥还原反应,其中可能在有机分子中新产生羟基的反应类型是( )
| A. | ①②③ | B. | ①④⑥ | C. | ①②⑥ | D. | ②④⑤ |
8.意大利科学家最近合成了一种新型的氧分子,其化学式为O4,下列关于O4的说法正确的是( )
| A. | 一个分子O4由两个分子O2构成 | |
| B. | O4是一种单质 | |
| C. | 等体积的O4和O2含有相同数目的分子 | |
| D. | 等质量的O4和O2含有相同数目的氧原子 |
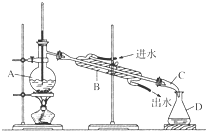 某同学设计了如图所示装置进行石油蒸馏的实验,请回答下列有关问题:
某同学设计了如图所示装置进行石油蒸馏的实验,请回答下列有关问题: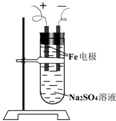 如图所示是用铁作电极,Na2SO4溶液作电解液,制备Fe(OH)2的改进装置.由于阴极产生的H2是还原性气体并且阻止了空气中的氧气进入溶液,所以,可以较长时间地保留Fe(OH)2白色絮状沉淀不变.请写出有关电极反应式:
如图所示是用铁作电极,Na2SO4溶液作电解液,制备Fe(OH)2的改进装置.由于阴极产生的H2是还原性气体并且阻止了空气中的氧气进入溶液,所以,可以较长时间地保留Fe(OH)2白色絮状沉淀不变.请写出有关电极反应式: