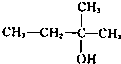
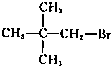
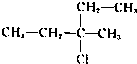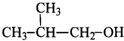题目内容
25℃时,下列各溶液中,微粒的物质的量浓度关系正确的是( )
| A.0.1mol/LNa2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3) |
| B.0.1mol/LNH4Cl溶液:c(NH4+)=c(Cl-) |
| C.pH=8.3的NaHCO3溶液:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) |
| D.pH=11氨水与pH=3盐酸等体积混合c(Cl-)>c(NH4+)>c(OH-)=c(H+) |
A.0.1 mol/L Na2CO3溶液中,由质子守恒可知c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3),故A正确;
B.0.1 mol/L NH4Cl溶液,铵根离子水解,则:c(NH4+ )<c(Cl-),故B错误;
C.pH=8.3的NaHCO3溶液中,碳酸氢根离子的水解程度大于碳酸氢根离子的电离程度,所以溶液中碳酸的浓度大于碳酸根离子浓度,即:c(Na+)>c(HCO3-)>c(H2CO3)>c(CO32-),故C错误;
D.pH=11氨水中氢氧根离子浓度为0.003mol/L,一水合氨的浓度大于0.003mol/L;与pH=3盐酸中氢离子浓度为0.003mol/L,氯化氢的浓度为0.003mol/L,二者等体积混合后氨水过量,反应后的溶液显示碱性,离子浓度关系为:c(NH4+)>c(Cl-)>c(OH-)>c(H+),故D错误;
故选A.
B.0.1 mol/L NH4Cl溶液,铵根离子水解,则:c(NH4+ )<c(Cl-),故B错误;
C.pH=8.3的NaHCO3溶液中,碳酸氢根离子的水解程度大于碳酸氢根离子的电离程度,所以溶液中碳酸的浓度大于碳酸根离子浓度,即:c(Na+)>c(HCO3-)>c(H2CO3)>c(CO32-),故C错误;
D.pH=11氨水中氢氧根离子浓度为0.003mol/L,一水合氨的浓度大于0.003mol/L;与pH=3盐酸中氢离子浓度为0.003mol/L,氯化氢的浓度为0.003mol/L,二者等体积混合后氨水过量,反应后的溶液显示碱性,离子浓度关系为:c(NH4+)>c(Cl-)>c(OH-)>c(H+),故D错误;
故选A.

练习册系列答案
 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案
相关题目
 )
) )>c(H2CO3)
)>c(H2CO3)