题目内容
已知反应:FeO(s)+CO(g)=Fe(s)+CO2(g)的Kc=0.5(1273K).若起始浓度c(CO)=0.05 mol/L,c(CO2)=0.01 mol·L-1,请回答:
(1)判断化学反应进行的方向并计算反应物、生成物的平衡浓度.
(2)CO的转化率是多少?
(3)增加FeO的量,对平衡有无影响?
答案:
解析:
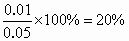
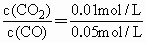 =0.2
=0.2
解析:
答
:(1)CO和CO2的平衡浓度分别为0.04 mol·L-1、0.02 mol·L-1;(2)CO
的转化率CO%=(3)无影响.
解
:Qc=Qc<Kc,反应将向右进行,设平衡时CO2增加的浓度为x
mol·L-1,则达到平衡时:FeO(s)+CO(g)=Fe(s)+CO2(g)
(mol·L-1)0.05-x 0.01+x
Kc=![]()
解之,x=0.01 mol·L-1
[CO]=0.05 mol·L-1-0.01 mol·L-1=0.04 mol·L-1
[CO2]=0.01 mol·L-1+0.01 mol·L-1=0.02 mol·L-1

练习册系列答案
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案
相关题目