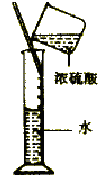��Ŀ����
����Ŀ��ijС���о� Na2S ��Һ�� KMnO4 ��Һ��Ӧ��̽���������¡�

����:��.MnO4 ��ǿ���������±���ԭΪ Mn2+���ڽ����������±���ԭΪ MnO2.
��.�����������������Һ����Һ�ʵ���ɫ��
��1������ʵ���֪��Na2S ����________�ԡ�
��2����ͬѧԤ��ʵ��I��S2���������� SO32-��
�ٸ���ʵ��������ͬѧ��Ϊ��Ԥ�ⲻ������������_______________��
����ͬѧȡʵ�����������Һ����ʵ�飬���� SO42�����ó� S2���������� SO42���Ľ��ۣ���ͬѧ�ý��ۣ�������_______________��
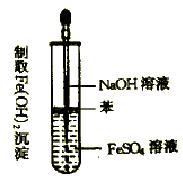
��ͬѧ�Ǿ����ۺ������������ͼ��ʵ�飬֤ʵ�������� MnO4-��ȷ���Խ� S2��������SO42����
a.����ձ��е���Һ��__________��
b.��ͨ�������ָ��ƫת��һ��ʱ���_________�������������֤��S2��������ΪSO42����
��3��ʵ�� I ������������ i ���ڲ��죬��ԭ���������ɵIJ��Mn2+��������ķ�Ӧ�MnO4-��������Ӧ���÷�Ӧ�����ӷ���ʽ��______________��
��4��ʵ��������������Ҳ����ȫ�������ͬѧ������ԭ���루3�����ƣ�����֤�������������ʵ�鷽��_______��
��5����˼��ʵ�飬��Ӧ����ͬ��������ͬ�����������ʱ仯�������������������йأ�����__________�����йء�
���𰸡� ��ԭ ��Һ����ɫ.˵������KMnO4��Һ����![]() SO32-�ܱ���������� KMnO4��Һ����H2SO4�ữ�ģ�����Һ�м���SO42-����֤��һ�������������ɵ� 0.1mol/LNa2S��Һ ȡ����ձ��е���Һ,�������ữ��,
SO32-�ܱ���������� KMnO4��Һ����H2SO4�ữ�ģ�����Һ�м���SO42-����֤��һ�������������ɵ� 0.1mol/LNa2S��Һ ȡ����ձ��е���Һ,�������ữ��, ![]() �μ�BaCl2��Һ.�۲쵽�а�ɫ�������� 2MnO4-+3Mn2++2H2O=5MnO2��+H+ ��ʵ��I�����ɵ�MnO2����ϴ�Ӻ�(��ȡMnO2)������0.1mol/LNa2S��Һ.�۲쵽��dz��ɫ����.����Һ�ʵ���ɫF֤�������ɵ�MnO2�������S ��Ӧ.��û�õ�MnO2 ���� ��������Һ�������
�μ�BaCl2��Һ.�۲쵽�а�ɫ�������� 2MnO4-+3Mn2++2H2O=5MnO2��+H+ ��ʵ��I�����ɵ�MnO2����ϴ�Ӻ�(��ȡMnO2)������0.1mol/LNa2S��Һ.�۲쵽��dz��ɫ����.����Һ�ʵ���ɫF֤�������ɵ�MnO2�������S ��Ӧ.��û�õ�MnO2 ���� ��������Һ�������
��������(1)����ʵ��I��֪�����������Һ����ɫ��dz��˵��Na2S ���л�ԭ�ԣ��ʴ�Ϊ����ԭ��
(2)�ٸ���ʵ��������Һ����ɫ��˵������KMnO4��Һ������SO32-�ܱ��������������˼�Ԥ�ⲻ�������ʴ�Ϊ����Һ����ɫ��˵������KMnO4��Һ������SO32-�ܱ������������
��KMnO4��Һ����H2SO4�ữ�ģ�����Һ�м���SO42-����֤��һ�������������ɵģ����S2���������� SO42���Ľ��۲��������ʴ�Ϊ��KMnO4��Һ����H2SO4�ữ�ģ�����Һ�м���SO42-����֤��һ�������������ɵģ�
��a.����ͼʾ������ձ��з���������Ӧ��Ϊԭ��صĸ������������⣬Ҫ�ﵽMnO4-�� S2��������SO42����Ŀ�ģ�����ձ��е���Һ������0.1mol/LNa2S��Һ���Ҳ��ձ��е���Һ������0.1mol/LKMnO4 ��Һ���ʴ�Ϊ��0.1mol/LNa2S��Һ��
b.��ͨ���������������Һ����������ԭ��Ӧ��������ָ��ƫת��һ��ʱ���ȡ����ձ��е���Һ���������ữ�μ�BaCl2��Һ���۲쵽�а�ɫ�������ɣ�֤�� S2��������Ϊ SO42�����ʴ�Ϊ��ȡ����ձ��е���Һ���������ữ�μ�BaCl2��Һ���۲쵽�а�ɫ����������
(3)Mn2+�������MnO4-��Ӧ���ɶ������̳�������Ӧ�����ӷ���ʽΪ2MnO4-+3Mn2++2H2O=5MnO2��+H+���ʴ�Ϊ��2MnO4-+3Mn2++2H2O=5MnO2��+H+��
(4)ʵ��������������Ҳ����ȫ�������ͬѧ������ԭ����(3)���ƣ�����֤���������ʵ�鷽������Ϊ����ʵ��I�����ɵ�MnO2����ϴ�Ӻ�(��ȡMnO2)������0.1mol/LNa2S��Һ.�۲쵽��dz��ɫ����.����Һ�ʵ���ɫF֤�������ɵ�MnO2�������S��Ӧ.��û�õ�MnO2�������ʴ�Ϊ����ʵ��I�����ɵ�MnO2����ϴ�Ӻ�(��ȡMnO2)������0.1mol/LNa2S��Һ.�۲쵽��dz��ɫ����.����Һ�ʵ���ɫF֤�������ɵ�MnO2�������S��Ӧ.��û�õ�MnO2������
(5)��˼��ʵ�飬��Ӧ����ͬ��������ͬ�����������ʱ仯�������������������йأ����뷴Ӧ�����������Һ������Ե������йأ��ʴ�Ϊ����Ӧ�����������Һ������ԡ�

 ����ѵ�����⿼ϵ�д�
����ѵ�����⿼ϵ�д�