题目内容
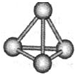 意大利罗马大学的FuNvio Cacace等人获得了极具理论研究意义的N4分子.N4分子结构如图所示,已知断裂lmolN-N吸收167kJ热量,生成1mol N≡N放出945kJ热量.根据以上信息和数据,下列说法正确的是( )
意大利罗马大学的FuNvio Cacace等人获得了极具理论研究意义的N4分子.N4分子结构如图所示,已知断裂lmolN-N吸收167kJ热量,生成1mol N≡N放出945kJ热量.根据以上信息和数据,下列说法正确的是( )| A、N4晶体属于由非极性键构成的分子晶体 | B、氮元素非金属性比磷强,可知N4沸点比P4(白磷)高 | C、1mol N4气体转变为N2气体吸收888kJ热量 | D、N4与N2互为同分异构体 |
分析:A.同种元素原子形成非极性共价键,分子结构对称,正负电荷重心重叠,形成的分子为非极性分子;
B.N4、P4(白磷)都是分子晶体,根据影响分子晶体的熔沸点高低的因素分析;
C.根据化学键断裂要吸收热量,形成化学键要放出热量,分别计算后进行比较;
D.N4与N2只有N元素组成,是单质,依据同素异形体、同位素的概念分析.
B.N4、P4(白磷)都是分子晶体,根据影响分子晶体的熔沸点高低的因素分析;
C.根据化学键断裂要吸收热量,形成化学键要放出热量,分别计算后进行比较;
D.N4与N2只有N元素组成,是单质,依据同素异形体、同位素的概念分析.
解答:解:A.N4同种元素原子形成非极性共价键,分子结构对称,正负电荷重心重叠,为非极性分子,故A正确;
B.N4和P4都是分子晶体,并且结构相似,相对分子质量越大,分子间作用力越强,沸点越高,所以白磷的沸点高,故B错误;
C.1molN4气体中含有6molN-N键,可生成2molN2,形成2molN≡N键,则1moN4气体转变为N2化学键断裂断裂吸收的热量为6×167KJ=1002KJ,形成化学键放出的热量为2×945kJ=1890KJ,所以反应放热,放出的热量为1890KJ-1002KJ=888KJ,故应为放出888KJ热量,故C错误;
D.N4与N2是同种元素形成的不同单质,是同素异形体,故D错误;
故选A.
B.N4和P4都是分子晶体,并且结构相似,相对分子质量越大,分子间作用力越强,沸点越高,所以白磷的沸点高,故B错误;
C.1molN4气体中含有6molN-N键,可生成2molN2,形成2molN≡N键,则1moN4气体转变为N2化学键断裂断裂吸收的热量为6×167KJ=1002KJ,形成化学键放出的热量为2×945kJ=1890KJ,所以反应放热,放出的热量为1890KJ-1002KJ=888KJ,故应为放出888KJ热量,故C错误;
D.N4与N2是同种元素形成的不同单质,是同素异形体,故D错误;
故选A.
点评:本题考查较为综合,涉及物质的组成和分类、分子的极性、分子晶体熔点的比较、反应热的计算,题目难度不大,注意基础知识的把握.

练习册系列答案
相关题目
 A.N4与N2互为同素异形体
A.N4与N2互为同素异形体