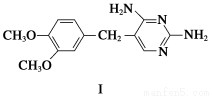
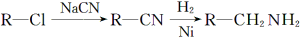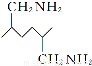题目内容
某矿石由前20号元素中的4种组成,其化学式为WmYnZpXq。X、Y、Z、W分布在三个周期,原子序数依次增大,W、Y为金属元素,X原子的最外层电子数是次外层电子数的3倍,W单质能与冷水剧烈反应,Y、Z原子的最外层电子数之和与X、W原子的最外层电子数之和相等,Y、Z位于同周期,Z单质是一种良好的半导体。下列说法正确的是( )
A.气态氢化物的稳定性:X<Z
B.含有1 mol Y的氯化物的水溶液中离子总数为4 mol(不考虑水的电离)
C.W位于第三周期ⅠA族,其原子半径比其他元素的都大
D.2 mol W单质和1 mol Y单质投入足量的水中会产生2.5 mol气体
D
【解析】元素推断题是考查物质结构、元素周期律(表)、元素性质的重要题型,主要考查“位—构—性”关系和元素化合物知识。X原子的最外层电子数是次外层电子数的3倍,表明X是O元素。Z单质是良好的半导体,表明Z是Si元素。W单质能与冷水剧烈反应,W可能是K或Ca元素,若W是K元素,进一步得出Y原子的最外层电子数为3,且Y为金属元素,可知Y为Al元素;若W是Ca元素,则同理得出Y最外层电数为4,Y不是金属元素,舍去。从而知W为K,Y为Al。2 mol K投入水中产生1 mol气体,
1 mol Al与足量的KOH反应产生1.5 mol气体,D正确。

 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案根据下列条件计算有关反应的焓变:
(1)已知:Ti(s)+2Cl2(g)=TiCl4(l)ΔH=-804.2 kJ·mol-1
2Na(s)+Cl2(g)=2NaCl(s) ΔH=-882.0 kJ·mol-1
Na(s)=Na(l) ΔH=+2.6 kJ·mol-1
则反应TiCl4(l)+4Na(l)=Ti(s)+4NaCl(s)的ΔH=________ kJ·mol-1。
(2)已知下列反应数值:
反应序号 | 化学反应 | 反应热 |
① | Fe2O3(s)+3CO(g)= 2Fe(s)+3CO2(g) | ΔH1=-26.7 kJ·mol-1 |
② | 3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) | ΔH2=-50.8 kJ·mol- |
③ | Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) | ΔH3=-36.5 kJ·mol-1 |
④ | FeO(s)+CO(g)=Fe(s)+CO2(g) | ΔH4 |
则反应④的ΔH4=____________ kJ·mol-1。