题目内容
(2011?合肥一模)下图甲和乙是双液原电池装置.由图可判断下列说法错误的是( )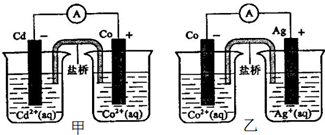

分析:A、原电池中负极上失电子,正极上得电子,根据正负极上得失电子写出反应方程式.
B、负极上失电子正极上得电子,根据正负极上得失电子判断方程式是否正确.
C、原电池放电时,盐桥中阴阳离子定向移动,形成闭合回路.
D、根据电池反应式计算析出的金属质量.
B、负极上失电子正极上得电子,根据正负极上得失电子判断方程式是否正确.
C、原电池放电时,盐桥中阴阳离子定向移动,形成闭合回路.
D、根据电池反应式计算析出的金属质量.
解答:解:A、甲图中,Cd作负极,负极上失电子发生氧化反应,Co作正极,正极上溶液中金属阳离子得电子发生还原反应生成金属单质,所以电池反应式为Cd(s)+Co2+(aq)=Co(s)+Cd2+(aq),故A正确.
B、乙图中,Co作负极,负极上失电子发生氧化反应,Ag作正极,正极上银离子得电子发生还原反应生成银单质,电极反应式为Co(s)+2Ag+(aq)=2Ag(s)+Co2+(aq),故B错误.
C、原电池放电时,负极上失去电子,正极上得电子,电子从负极沿导线流向正极,如果没有盐桥,不能形成闭合回路,没有电流产生,盐挢的作用是形成闭合回路,并使两边溶液保持电中性,故C正确.
D、Cd(s)+2Ag+(aq)=2Ag(s)+Cd2+(aq) 转移电子
216g 2mol
108g 1mol
所以当有lmol电子通过外电路时,正极有108克Ag析出,故D正确.
故选B.
B、乙图中,Co作负极,负极上失电子发生氧化反应,Ag作正极,正极上银离子得电子发生还原反应生成银单质,电极反应式为Co(s)+2Ag+(aq)=2Ag(s)+Co2+(aq),故B错误.
C、原电池放电时,负极上失去电子,正极上得电子,电子从负极沿导线流向正极,如果没有盐桥,不能形成闭合回路,没有电流产生,盐挢的作用是形成闭合回路,并使两边溶液保持电中性,故C正确.
D、Cd(s)+2Ag+(aq)=2Ag(s)+Cd2+(aq) 转移电子
216g 2mol
108g 1mol
所以当有lmol电子通过外电路时,正极有108克Ag析出,故D正确.
故选B.
点评:本题考查了原电池原理,难度不大,明确正负极上发生反应的类型、转移电子和析出金属的关系、盐桥的作用即可解答本题.

练习册系列答案
相关题目
