题目内容
(2011?嘉兴模拟)工业上用矿物M(含有X、Y、Z三种元素)在空气中高温煅烧,X、Y、Z分别转化成A、B、C三种产物,A、B、C的物质的量之比为1:1:2,其中A为单质,9.6g A溶于稀硝酸后产生标准状况下2.24L气体G,G遇空气呈红棕色,所得溶液中滴加浓氨水至过量,先产生沉淀,后沉淀溶解;B中Y元素与氧元素的质量比为7:2,B溶于适量的稀硝酸得到溶液W和无色气体G,W溶液中滴入硫氰化钾溶液呈血红色; C为酸性氧化物,且常温下呈气态,将C通入氯化钡溶液中,无明显变化现象,再滴加双氧水产生白色沉淀.
(1)指出Z元素在周期表中的位置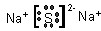
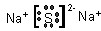 ;
;
(2)写出C与双氧水、氯化钡溶液产生沉淀的离子反应方程式
(3)在游泳池中通常用X的硫酸盐来消毒杀菌,试说明该盐能起消毒杀菌作用的本质原因是
(4)将X的单质溶于N2O4的乙酸乙酯溶液中可制得Y的无水硝酸盐,同时生成G,请写出以上反应的化学方程式
(1)指出Z元素在周期表中的位置
第3周期,ⅥA族
第3周期,ⅥA族
,Z与处于同一周期且原子半径最大的元素(除稀有气体)所形成的稳定化合物电子式为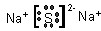
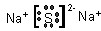
(2)写出C与双氧水、氯化钡溶液产生沉淀的离子反应方程式
H2O2+SO2+Ba2+=BaSO4↓+2H+
H2O2+SO2+Ba2+=BaSO4↓+2H+
;(3)在游泳池中通常用X的硫酸盐来消毒杀菌,试说明该盐能起消毒杀菌作用的本质原因是
Cu2+使蛋白质变性
Cu2+使蛋白质变性
;试推断M的化学式为CuFeS2
CuFeS2
.(4)将X的单质溶于N2O4的乙酸乙酯溶液中可制得Y的无水硝酸盐,同时生成G,请写出以上反应的化学方程式
Cu+2N2O4=Cu(NO3)2+2NO↑
Cu+2N2O4=Cu(NO3)2+2NO↑
.分析:工业上用矿物M(含有X、Y、Z三种元素)在空气中高温煅烧,X、Y、Z分别转化成A、B、C三种产物,A、B、C的物质的量之比为1:1:2,其中A为单质,9.6g A溶于稀硝酸后产生标准状况下2.24L气体G,G遇空气呈红棕色,判断G为NO;所得溶液中滴加浓氨水至过量,先产生沉淀,后沉淀溶解,推断A为Cu;氢氧化铜溶于过量氨水;B溶于适量的稀硝酸得到溶液W和无色气体G,W溶液中滴入硫氰化钾溶液呈血红色,证明M中含有三价铁离子,B中Y元素为铁元素与氧元素的质量比为7:2,计算得到B为氧化亚铁FeO;W为Fe(NO3)3; C为酸性氧化物,且常温下呈气态,将C通入氯化钡溶液中,无明显变化现象,再滴加双氧水产生白色沉淀,分析判断气体C是二氧化硫,被过氧化氢氧化为硫酸和氯化钡反应生成沉淀;根据M和氧气反应生成ABC,A、B、C的物质的量之比为1:1:2,依据原子守恒和电子守恒,推断出M为CuFeS2;依据判断出的物质进行分析回答问题.
解答:解:工业上用矿物M(含有X、Y、Z三种元素)在空气中高温煅烧,X、Y、Z分别转化成A、B、C三种产物,A、B、C的物质的量之比为1:1:2,其中A为单质,9.6g A溶于稀硝酸后产生标准状况下2.24L气体G,G遇空气呈红棕色,判断G为NO;所得溶液中滴加浓氨水至过量,先产生沉淀,后沉淀溶解,推断A为Cu;B溶于适量的稀硝酸得到溶液W和无色气体G,W溶液中滴入硫氰化钾溶液呈血红色,证明M中含有三价铁离子,B中Y元素为铁元素与氧元素的质量比为7:2,计算得到B为氧化亚铁FeO;W为Fe(NO3)3; C为酸性氧化物,且常温下呈气态,将C通入氯化钡溶液中,无明显变化现象,再滴加双氧水产生白色沉淀,分析判断气体C是二氧化硫,被过氧化氢氧化为硫酸和氯化钡反应生成沉淀;根据M和氧气反应生成ABC,A、B、C的物质的量之比为1:1:2,依据原子守恒和电子守恒,推断出M为CuFeS2;X为铜元素;Y为铁元素;Z为硫元素;
(1)Z元素是硫元素,在周期表中的位置为:第3周期,ⅥA族;Z与处于同一周期且原子半径最大的元素为Na元素,所形成的稳定化合物为硫化钠,电子式为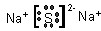 ,
,
故答案为:第3周期,ⅥA族;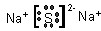 ;
;
(2)C为SO2,与双氧水、氯化钡溶液产生沉淀为硫酸钡,结合原子守恒和电子守恒写出反应的离子反应方程式:H2O2+SO2+Ba2+=BaSO4↓+2H+,
故答案为:H2O2+SO2+Ba2+=BaSO4↓+2H+;
(3)在游泳池中通常用X为铜元素,铜的硫酸盐来消毒杀菌,试说明该盐能起消毒杀菌作用的本质原因是:Cu2+使蛋白质变性;根据M和氧气反应生成ABC,A、B、C的物质的量之比为1:1:2,依据原子守恒和电子守恒,2CuFeS2+5O2=2Cu+2FeO+4SO2↑;推断出M的化学式为为:CuFeS2,
故答案为:Cu2+使蛋白质变性;CuFeS2;
(4)将X的单质为Cu,溶于N2O4的乙酸乙酯溶液中可制得A(Cu(NO3)2)的无水硝酸盐,同时生成G(NO),反应的化学方程式为:Cu+2N2O4=Cu(NO3)2+2NO↑,
故答案为:Cu+2N2O4=Cu(NO3)2+2NO↑;
(1)Z元素是硫元素,在周期表中的位置为:第3周期,ⅥA族;Z与处于同一周期且原子半径最大的元素为Na元素,所形成的稳定化合物为硫化钠,电子式为
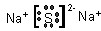 ,
,故答案为:第3周期,ⅥA族;
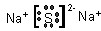 ;
;(2)C为SO2,与双氧水、氯化钡溶液产生沉淀为硫酸钡,结合原子守恒和电子守恒写出反应的离子反应方程式:H2O2+SO2+Ba2+=BaSO4↓+2H+,
故答案为:H2O2+SO2+Ba2+=BaSO4↓+2H+;
(3)在游泳池中通常用X为铜元素,铜的硫酸盐来消毒杀菌,试说明该盐能起消毒杀菌作用的本质原因是:Cu2+使蛋白质变性;根据M和氧气反应生成ABC,A、B、C的物质的量之比为1:1:2,依据原子守恒和电子守恒,2CuFeS2+5O2=2Cu+2FeO+4SO2↑;推断出M的化学式为为:CuFeS2,
故答案为:Cu2+使蛋白质变性;CuFeS2;
(4)将X的单质为Cu,溶于N2O4的乙酸乙酯溶液中可制得A(Cu(NO3)2)的无水硝酸盐,同时生成G(NO),反应的化学方程式为:Cu+2N2O4=Cu(NO3)2+2NO↑,
故答案为:Cu+2N2O4=Cu(NO3)2+2NO↑;
点评:本题考查了物质转化的推断应用,物质性质的综合应用,主要考查铜及其化合物、铁及其化合物、二氧化硫等物质性质的应用,离子方程式的书写,原子守恒、电子守恒的应用,题目综合性较强,难度较大.

练习册系列答案
相关题目
 (2011?嘉兴模拟)今年3月1日卫生部等7部委联合发布公告:自今年5月1日起,禁止在面粉生产中添加过氧化苯甲酰、过氧化钙做面粉增白剂;同时指出:“一滴香”(主要成分为乙基麦芽酚)属于咸味食品香精的一种,如按照标准使用对人体是无害的.过氧化苯甲酰与乙基麦芽酚的结构如图,则下列有关说法正确的是( )
(2011?嘉兴模拟)今年3月1日卫生部等7部委联合发布公告:自今年5月1日起,禁止在面粉生产中添加过氧化苯甲酰、过氧化钙做面粉增白剂;同时指出:“一滴香”(主要成分为乙基麦芽酚)属于咸味食品香精的一种,如按照标准使用对人体是无害的.过氧化苯甲酰与乙基麦芽酚的结构如图,则下列有关说法正确的是( )