��Ŀ����
����Ŀ�������Դ���й����Ŀ�����Ӧ��ǰ�����ɼ�����Ⱦ����������⣬���м״������������ʵ����ȼ�ϣ�������ȼ�ϵ�أ�һ����������CO��H2�ϳ�CH3OH��CO��g��+2H2��g��CH3OH��g����H=��105kJmol��1 �� �����Ϊ2L���ܱ������г���2molCO��4molH2 �� ��ò�ͬ�¶��������ڵ�ѹǿ��P��kPa����ʱ�䣨min���ı仯��ϵ��ͼ�Т�������ʾ��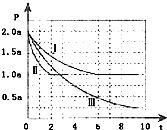
��1����͢���ȣ��ı�ķ�Ӧ������ ��
��2����Ӧ����6minʱ�ﵽƽ�⣬�ڴ������´ӷ�Ӧ��ʼ���ﵽƽ��ʱv��CH3OH��= ��
��3����Ӧ����2minʱ�ﵽƽ�⣬ƽ�ⳣ��K����= ��
��4���ȽϷ�Ӧ����¶ȣ�T1���ͷ�Ӧ����¶ȣ�T3���ĸߵͣ�T1T3���������������=�������жϵ������� ��
���𰸡�
��1������ʹ�ô���
��2��0.125mol/��L��min��
��3��12
��4�������˷�ӦΪ���ȷ�Ӧ�������¶ȣ���Ӧ���ʼ�����ƽ��������Ӧ�����ƶ�
���������⣺�٢�͢���ȷ�Ӧ���ʼӿ죬��Ӱ��ƽ���ƶ�������ӦΪ�������ʵ�����С�ķ�Ӧ��Ӧ��ʹ�ô��������Դ��ǣ�����ʹ�ô������ں��º����£�ѹǿ֮�ȵ����������ʵ���֮�ȣ���ƽ��ʱ������������ʵ���Ϊ��2+4��mol�� ![]() =3mol���� CO��g��+2H2 ��g��CH3OH��g�����ʵ�����С��n=2 ��ʼ����mol����2 4 0
=3mol���� CO��g��+2H2 ��g��CH3OH��g�����ʵ�����С��n=2 ��ʼ����mol����2 4 0
�仯����mol����1.5 3 1.5 6��3=3
ƽ������mol����0.5 1 1.5
��v��CH3OH��= ![]() =0.125 mol/��L��min����
=0.125 mol/��L��min����
���Դ��ǣ�0.125 mol/��L��min�����ۢ��¶���ͬ��ƽ�ⳣ����ͬ��ƽ�ⳣ��K����=K= ![]() =
= 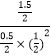 =12�����Դ��ǣ�12���ܷ�Ӧ���ƽ��ʱ���õ�ʱ��ȷ�Ӧ���ƽ��ʱ���õ�ʱ�䳤����ѧ��Ӧ���ʿ죬�Ң�ƽ��ʱѹǿ��IС����I���ƽ�������ƶ�������ӦΪ���������С���ȷ�Ӧ��Ӧ�����¶ȣ����¶�T1�¶ȸ��ߣ����Դ��ǣ������˷�ӦΪ���ȷ�Ӧ�������¶ȣ���Ӧ���ʼ�����ƽ��������Ӧ�����ƶ���
=12�����Դ��ǣ�12���ܷ�Ӧ���ƽ��ʱ���õ�ʱ��ȷ�Ӧ���ƽ��ʱ���õ�ʱ�䳤����ѧ��Ӧ���ʿ죬�Ң�ƽ��ʱѹǿ��IС����I���ƽ�������ƶ�������ӦΪ���������С���ȷ�Ӧ��Ӧ�����¶ȣ����¶�T1�¶ȸ��ߣ����Դ��ǣ������˷�ӦΪ���ȷ�Ӧ�������¶ȣ���Ӧ���ʼ�����ƽ��������Ӧ�����ƶ���
�����㾫����������Ҫ�����˻�ѧƽ��״̬���ʼ������ͻ�ѧƽ��ļ�������֪ʶ�㣬��Ҫ���ջ�ѧƽ��״̬�����������ȡ��� V��=V��>0�����������Ƕ�̬ƽ�⣬ƽ��ʱ��Ӧ���ڽ��У�����������Ӧ������и���ְٷֺ������䣻���䡱�������ı䣬ƽ�ⱻ���ƣ������µ������½����µĻ�ѧƽ�⣻��;���أ�����������䣬���淴Ӧ�����Ǵ�����Ӧ��ʼ�����Ǵ��淴Ӧ��ʼ�����ɽ���ͬһƽ��״̬����Ч������Ӧ��ת����=ת��Ũ�ȡ���ʼŨ�ȡ�100%=ת�����ʵ�������ʼ���ʵ�����100%����Ʒ�IJ���=ʵ�����ɲ�������ʵ����������Ͽɵõ���������ʵ�����100%������ȷ�����⣮

����Ŀ����ȥ���������е����ʣ�������Ϊ���ʣ������õ��Լ��ͳ��ӷ���������ǣ� ��
ѡ�� | �����ʵ����� | �Լ� | ���ӷ��� |
A | C2H4��SO2�� | NaOH��Һ | ϴ�� |
B | C6H6�����ӣ� | ŨBr2ˮ | ���� |
C | C6H5NO2��HNO3�� | NaOH��Һ | ��Һ |
D | C2H2��H2S�� | CuSO4��Һ | ϴ�� |
A.A
B.B
C.C
D.D