题目内容
9.已知反应2I-+S2O82-═I2+2SO42-,加入淀粉溶液可观察到溶液变蓝色.反应速率可以用淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大.20℃时得到如下实验数据:| 实验编号 | C(I-)/mol•L | C(S2O82-)/mol•L | t/s |
| 1 | 0.040 | 0.040 | 88.0 |
| 2 | 0.080 | 0.040 | 44.0 |
| 3 | 0.080 | 0.080 | 22.0 |
| 4 | 0.160 | 0.020 | 44.0 |
| 5 | 0.120 | 0.040 | 29.3 |
| A. | I-的浓度越大,反应速率越快 | |
| B. | S2O82- 的浓度越大,反应速率越快 | |
| C. | 该实验的目的是研究 I- 与S2O82- 的浓度对反应速率的影响 | |
| D. | 5个实验中,编号3对应浓度的实验,反应速率最慢 |
分析 A.反应速率取决于I- 与S2O82- 的浓度共同决定;
B.反应速率取决于I- 与S2O82- 的浓度共同决定;
C.表中,I- 与S2O82- 的浓度不同,反应速率不同;
D.编号3对应浓度的实验用时最少,反应最快.
解答 解:A.反应速率取决于I- 与S2O82- 的浓度,如I-浓度较大,而S2O82- 浓度较小,则反应速率不一定大,故A错误;
B.反应速率取决于I- 与S2O82- 的浓度,如S2O82- 浓度较大,而I-浓度较小,则反应速率不一定大,故B错误;
C.由题目中表格数据可分析出c(I-)、c(S2O32-)浓度越大,反应速率越快,显蓝色所需时间越少,故实验目的应是研究反应物I-与S2O82-的浓度对反应速率的影响,故C正确;
D.由表中数据可知,编号3对应浓度的实验用时最少,反应最快,故D错误.
故选:C.
点评 本题考查化学反应速、影响化学反应速率的外界因素(浓度)、学生对图表的观察、分析以及学生对实验数据的分析、整理、归纳等方面的思维能力,难度较大,解决该类试题应注意:①认真审题,明确实验目的,理解直接测量与实验目的间的逻辑和数学关系;②理解控制变量的思想在实验设计和数据分析中的运用.

练习册系列答案
 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案
相关题目
18.下列关于有机化合物的说法正确的是( )
| A. | 能发生银镜反应的有机物一定属于醛类 | |
| B. | 乙烯和聚乙烯互为同系物 | |
| C. | 室温下,乙醇在水中的溶解度大于溴乙烷 | |
| D. | 乙醇与乙醚互为同分异构体 |
17.下列有关物质结构的叙述正确的是( )
| A. | 一氯甲烷的电子式为: | B. | 乙醇分子的球棍模型为: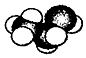 | ||
| C. | 甲苯分子中所有的原子可以共平面 | D. | 分子组成为C5H12的有机物有3种 |
4.下列物质中,含有共价键的离子化合物是( )
| A. | CaCl2 | B. | Na2O | C. | H2O | D. | NH4Cl |
1.自来水管与下列材料做成的水龙头连接,锈蚀最快的铁水管连接的是( )
| A. | 铜水龙头 | B. | 铁水龙头 | C. | 塑料水龙头 | D. | 陶瓷水龙头 |
2.NA代表阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 标准状况下,11.2 L水中含有的氢原子数为NA | |
| B. | 1 mol•L-1FeCl3溶液中,阳离子数为NA | |
| C. | 一定条件下,将1mol SO2和0.5 mol O2充入一密闭容器内,充分反应后的生成物分子数为NA | |
| D. | 在反应2Na2O2+2CO2═2Na2CO3+O2中,每生成0.5 molO2转移的电子数为NA |
3.常温下,下列有关电解质溶液的说法正确的是( )
| A. | 用少量水稀释0.1 mol/L氨水时,溶液中$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$ 减小 | |
| B. | 将Na2CO3溶液从20℃升温至30℃,溶液中$\frac{c(C{O}_{3}^{2-})}{c(HC{O}_{3}^{-})•c(O{H}^{-})}$ 增大 | |
| C. | 0.1 mol/L Na2CO3与0.1 mol/L NaHCO3溶液等体积混合:3c(Na+)=2[c(CO32-)+c(HCO3-)+c(H2CO3)] | |
| D. | 0.1 mol/L的NaOH溶液和0.2 mol/L的NH4Cl溶液等体积混合后:c(OH-)-c(H+)=c(Na+)-c(NH3•H2O) |

 不能最终被氧化为-COOH;
不能最终被氧化为-COOH;