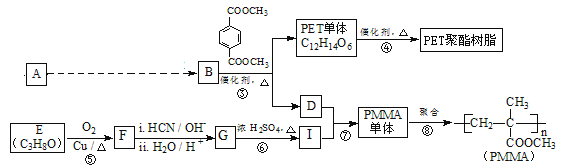
题目内容
【题目】图甲是CO2电催化还原为碳氢化合物(CxHy)的工作原理示意图,用某钾盐水溶液做电解液;图乙是用H2还原CO2制备甲醇的工作原理示意图,用硫酸为电解质溶液。下列说法中不正确的是
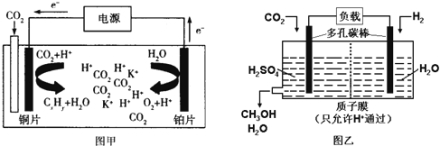
A.甲中铜片作阴极,K+向铜片电极移动
B.甲中若CxHy为C2H4,则生成1mol C2H4的同时生成3mol O2
C.乙中H2SO4的作用是增强溶液的导电性
D.乙中正极发生的电极反应为CO2+5e-+6H+═CH3OH+H2O
【答案】D
【解析】
试题分析:A.电解时,电子流向是:阳极→正极→负极→阴极,铜为阴极,所以阳离子K+向铜片电极移动,A正确;B.若CxHy为C2H4,则电解的总反应为:2CO2+2H2O![]() 3O2+C2H4,所以生成1 mol C2H4的同时生成3 molO2,B正确;C.乙中电解质溶液H2SO4的作用是增强导电性,C正确;D.由图可知乙中正极上是二氧化碳发生得电子的还原反应的过程,发生的电极反应为CO2+6e-+6H+=CH3OH+H2O故D错误;答案选D。
3O2+C2H4,所以生成1 mol C2H4的同时生成3 molO2,B正确;C.乙中电解质溶液H2SO4的作用是增强导电性,C正确;D.由图可知乙中正极上是二氧化碳发生得电子的还原反应的过程,发生的电极反应为CO2+6e-+6H+=CH3OH+H2O故D错误;答案选D。

【题目】现有几种元素的性质或原子结构如下表:
元素编号 | 元素性质或原子结构 |
T | 失去一个电子后,形成Ne原子电子层结构 |
X | 短周期非金属,其最外层电子数是次外层电子数的一半 |
Y | 其单质之一是空气中主要成分,最常见的助燃剂 |
Z | 形成双原子单质分子,黄绿色气体 |
(1)工业制备X单质反应的化学方程式_______________________________;
(2)画出T的离子结构示意图__________;
(3)写出实验室利用浓盐酸和二氧化锰制取单质Z的离子方程式______________________;
(4)由T和Y两种元素组成的一种阴阳离子个数比为1:2的过氧化物,其电子式为___________。写出该物质的一种用途__________________________________
(5)T、Z的最高价氧化物对应的水化物相互反应的离子方程式为___________________。