题目内容
常温下,往H2O2溶液中滴加少量FeSO4溶液,可发生如下两个反应:
2Fe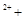 H2O2
H2O2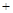 2H
2H → 2Fe
→ 2Fe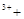 2H2O 2Fe
2H2O 2Fe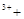 H2O2 → 2Fe
H2O2 → 2Fe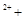 O2↑
O2↑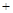 2H
2H
下列说法正确的是( )
2Fe
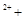 H2O2
H2O2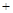 2H
2H → 2Fe
→ 2Fe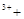 2H2O 2Fe
2H2O 2Fe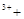 H2O2 → 2Fe
H2O2 → 2Fe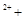 O2↑
O2↑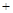 2H
2H
下列说法正确的是( )
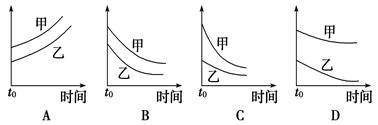
A.H2O2的氧化性比Fe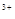 强,其还原性比Fe 强,其还原性比Fe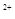 弱 弱 |
| B.在H2O2分解过程中,溶液的pH逐渐下降 |
C.在H2O2分解过程中,Fe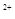 和Fe 和Fe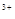 的总量保持不变 的总量保持不变 |
D.H2O2生产过程要严格避免混入Fe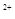 |
CD
首先要明确铁离子是起催化剂的作用,两个反应相加得2H2O2=2H2O+O2↑。因此在分解过程中H+的浓度不变,故溶液的pH不变。由于双氧水的量远大于亚铁离子,而且两个反应循环进行,故亚铁离子、铁离子的总量不变。在双氧水的生成中要避免其分解,故D的说法正确。对于A选项,第一个反应是在酸性条件下,得出的结论是正确的,但是第二个反应是在中性条件下进行的,得出的结论相反,故要比较其氧化还原性要指明反应条件的介质。答案选CD。

练习册系列答案
相关题目
 2SO3,下列说法错误的是
2SO3,下列说法错误的是 C(g)+D(g)在一定条件下已达到平衡的事实是
C(g)+D(g)在一定条件下已达到平衡的事实是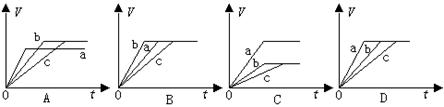
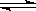 H2+I2 Ⅲ.2H2SO4===2SO2+O2+2H2O
H2+I2 Ⅲ.2H2SO4===2SO2+O2+2H2O