题目内容
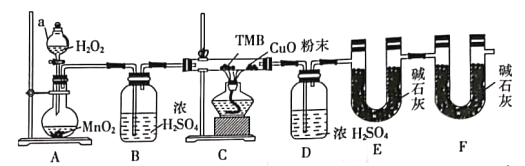
【题目】实验室用浓盐酸和 MnO2 制 Cl2,并以氯气为原料制备氯化铁,已知氯化铁容易与水发生水解反应,装 置如下图所示。

(1)装置 A 烧瓶中发生反应的化学方程式为:______________。
(2)装置 B、C 中应盛放的试剂名称分别为___________、________________若装置去掉 B、C,将对实验产生的安全隐患是_____________
(3)实验时,先点燃 A 处的酒精灯,让氯气充满装置,再点燃 D 处酒精灯,写出 D 中反应的化学方程式:_____。
(4)F 装置所起的作用是_____,_____。
(5)用廉价的石灰乳吸收氯气可制得漂粉精,写出工业制漂粉精反应的化学方程式:____________。
【答案】MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O 饱和食盐水 浓硫酸 HCl 和水蒸气进入 D 中与铁反应生成 H2,H2 和 Cl2 混合加热易发生爆炸 2Fe+3Cl2
MnCl2+Cl2↑+2H2O 饱和食盐水 浓硫酸 HCl 和水蒸气进入 D 中与铁反应生成 H2,H2 和 Cl2 混合加热易发生爆炸 2Fe+3Cl2![]() 2FeCl3 吸收多余的氯气,防止其逸出污染环境 防止空气中的水蒸气进入 D 中 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
2FeCl3 吸收多余的氯气,防止其逸出污染环境 防止空气中的水蒸气进入 D 中 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
【解析】
(1)二氧化锰与浓盐酸在加热条件下反应生成二氯化锰和氯气、水,据此写出方程式;
(2)浓盐酸具有挥发性,所以混合气体中含有氯化氢,需用饱和食盐水除去氯化氢,用浓硫酸吸收水蒸气;若没有这两步操作,盐酸与铁反应产生的氢气与氯气混合受热会发生爆炸;
(3)铁粉与氯气在加热条件下反应生成氯化铁;
(4)反应后剩余的氯气需要吸收,空气中的水蒸气不能进入D装置内,影响实验,据此分析碱石灰的作用。
(5)氯气和氢氧化钙反应生成氯化钙、次氯酸钙和水,据此写出方程式;
(1)二氧化锰与浓盐酸在加热条件下反应生成二氯化锰和氯气、水,方程式为:MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;
故答案是:MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;
(2)浓盐酸具有挥发性,所以混合气体中含有氯化氢,氯化氢易溶于水,氯气难溶于饱和食盐水,所以选饱和食盐水除去氯化氢;因题中要求制备氯化铁,所以要除去氯气中混有的水蒸气,且不引进新的杂质、氯气也和该物质不反应,所以选浓硫酸;因浓盐酸具有挥发性,反应生成物中有水,在加热条件下变成水蒸气,所以混合气体中的成分是氯化氢、水蒸气、氯气,氯化氢和铁能反应生成氢气,氢气和氯气混合会发生爆炸;
故答案是:饱和食盐水;浓硫酸;HCl 和水蒸气进入 D 中与铁反应生成 H2,H2 和 Cl2 混合加热易发生爆炸;
(3)铁粉与氯气在加热条件下反应生成氯化铁,方程式为:2Fe+3Cl2![]() 2FeCl3;
2FeCl3;
故答案是:2Fe+3Cl2![]() 2FeCl3;
2FeCl3;
(4)氯气有毒,污染环境,所以不能排空,碱石灰的成分是氧化钙和氢氧化钠,氯气和氧化钙、氢氧化钠能反应,所以可用碱石灰处理尾气,空气中有水蒸气,碱石灰还能吸收水蒸气,所以可作干燥剂,防止水蒸气进行D装置干扰实验;
故答案是:吸收多余的氯气,防止其逸出污染环境;防止空气中的水蒸气进入 D 中;
(5)氯气和氢氧化钙反应生成氯化钙、次氯酸钙和水,反应方程式为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;
故答案是:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O。