题目内容
下列判断错误的是( )
| A.熔点:SiO2>NaCl>SiCl4 | B.稳定性:AsH3 >PH3> NH3 |
| C.酸性:HClO4>H2SO4>H3PO4 | D.碱性:NaOH>Mg(OH)2>Al(OH)3 |
B
解析试题分析:A选项中SiO2为原子晶体NaCl为离子晶体 SiCl4为分子晶体,而原子晶体的熔点大于离子晶体,离子晶体大于分子晶体,故A选项是正确的。B选项,稳定性的比较,我们可以从比较原子半径大小方面进行比较,原子半径越小,稳定性越强,氮在第二周期,P在第三周期,砷在第四周期,故氮的半径最小,接着到磷,砷最大,故它们的稳定性跟B选项列出来的相反了,所以B选项是错误的。而C、D选项,半径越小酸性越强,半径越大碱性越强,故C、D选项是正确的。
考点:考查元素周期律的相关知识点

练习册系列答案
 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案
相关题目
在元素周期表中金属与非金属的分界处,可以找到( )
| A.合金 | B.半导体材料 | C.催化剂 | D.农药 |
关于下列各组物质的相互关系,判断正确的是( )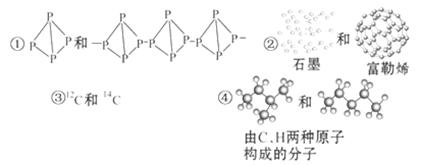

| A.互为同素异形体的是①② | B.互为同位素的是②③ |
| C.互为同一物质的是①⑤ | D.互为同分异构体的是④⑤ |
元素周期表中某区域的一些元素多用于制造半导体材料,它们是( )
| A.左、下方区域的金属元素 |
| B.金属元素和非金属元素分界线附近的元素 |
| C.右、上方区域的非金属元素 |
| D.稀有气体元素 |
下图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是( )[来源&:中*^教@#网]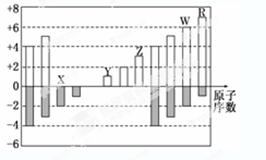
| A.原子半径:Z>Y>X |
| B.气态氢化物的稳定性:W>R |
| C.WX3和水反应形成的化合物是离子化合物[来*源#^@:中国教育出版~网] |
| D.Y和Z两者最高价氧化物对应的水化物能相互反应 |
如果发现了原子序数为116的元素,下列对它的叙述中正确的是 ( )
①位于第7周期 ②非金属元素 ③最外电子层有6个电子 ④没有放射性 ⑤属于氧族元素 ⑥属于锕系元素
| A.①③⑤ | B.②④⑥ | C.①③⑥ | D.③④⑤ |
短周期元素X、Y、Z在元素周期表中的位置如图所示,其中Y与Z的原子最外层电子数之比为2:1.下列说法不正确的是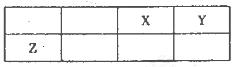
| A.X与Y只能形成两种化台物 |
| B.简单离子的半径大小:Y<X |
| C.X、Y、Z三种元素形成的化合物中既存在共价键又存在离子键 |
| D.Z形成的简单离子是其所在周期元素形成的简单离子中半径最小的 |
最近,意大利科学家使用普通氧分子和带正电荷的氧离子制造出了由4个氧原子构成的氧分子O4,并用质谱仪探测到了它存在的证据。下列说法正确的是
| A.O4是氧元素的一种同位素 |
| B.O4可能含有极性键 |
| C.同温同压下,等体积的O4气体和O2含有相同的分子数 |
| D.O4转化O2为物理变化 |