题目内容
(1)分别取Wg钠、镁、铝与足量的盐酸反应,在相同条件下产生氢气的体积比是______;(2)分别取0.1mol钠、镁、铝与足量的盐酸反应,在相同条件下产生氢气的体积比是______;
(3)若产生相同物质的量的氢气,所需钠、镁、铝的质量比为______;
(4)若产生相同体积(同温同压下)的氢气,所需钠、镁、铝三种金属的物质的量之比为______;
(5)若将0.2mol金属钠、铝、铁分别投入到10mL 1mol/L的盐酸中,在标准状况下,产生氢气的体积大小顺序是______;
(6)把0.5mol钠投入到m1g水(过量)中得到a溶液,把0.5mol镁投入到m2g盐酸(过量)中得到b溶液,若m1=m2,则a、b质量的大小关系是______.
【答案】分析:题中涉及到的化学方程式有①2Na+2HCl=2NaCl+H2↑,②Mg+2HCl=MgCl2+H2↑,③2Al+6HCl=2AlCl3+3H2↑,④Fe+2HCl=FeCl2+H2↑,根据各反应物的物质的量结合化学方程式计算.
解答:解:涉及到的化学方程式有①2Na+2HCl=2NaCl+H2↑,②Mg+2HCl=MgCl2+H2↑,③2Al+6HCl=2AlCl3+3H2↑,
④Fe+2HCl=FeCl2+H2↑,
(1)设分别取Wg钠、镁、铝与足量的盐酸反应,在相同条件下产生氢气的体积分别为x、y、z,
2Na+2HCl=2NaCl+H2↑
46g 22.4L
Wg x
x=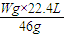 =
=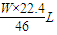 ,
,
Mg+2HCl=MgCl2+H2↑
24g 22.4L
Wg y
y=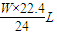 ,
,
2Al+6HCl=2AlCl3+3H2↑
54g 67.2L
Wg z
z=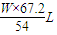 ,
,
x:y:z=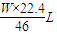 :
: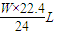 :
: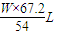 =
=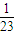 :
: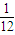 :
: ,故答案为:=
,故答案为:=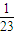 :
: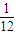 :
: ;
;
(2)由反应方程式可知,
分别取0.1mol钠、镁、铝与足量的盐酸反应,在相同条件下产生氢气的体积比等于物质的量之比,为 :1:
:1: =1:2:3,故答案为:1:2:3;
=1:2:3,故答案为:1:2:3;
(3)设反应各生成1mol氢气,
则需m(Na)=46g,m(Mg)=24g,m(Al)= ×27g=18g,
×27g=18g,
产生相同物质的量的氢气,所需钠、镁、铝的质量比为46:24:18=23:12:9,故答案为:23:12:9;
(4)由反应方程式可知,
若产生相同体积(同温同压下)的氢气,所需钠、镁、铝三种金属的物质的量之比为2mol:1mol: mol=6:3:2,故答案为:6:3:2;
mol=6:3:2,故答案为:6:3:2;
(5)10mL 1mol/L的盐酸的物质的量为0.01L×1mol/L=0.01mol,若将0.2mol金属钠、铝、铁分别投入到10mL 1mol/L的盐酸中,可知三种金u属都过量,盐酸不足,完全反应,但金属钠能与水反应继续生成氢气,所以钠反应生成氢气最多,铝、铁反应生成氢气一样多,故答案为:Na>Al=Fe;
(6)利用差量法计算:
2Na+2H2O=2NaOH+H2↑△m
2mol 44g
0.5mol 11g
Mg+2HCl=MgCl2+H2↑△m
1mol 22g
0.5mol 11g
可知把0.5mol钠投入到m1g水(过量)中得到a溶液,把0.5mol镁投入到m2g盐酸(过量)中得到b溶液,溶液增加的质量相同,又m1=m2,则a、b质量的大小相等,
故答案为:=.
点评:本题考查化学方程式的相关计算,题目难度不大,注意金属性质的不同性以及差量法的计算应用.
解答:解:涉及到的化学方程式有①2Na+2HCl=2NaCl+H2↑,②Mg+2HCl=MgCl2+H2↑,③2Al+6HCl=2AlCl3+3H2↑,
④Fe+2HCl=FeCl2+H2↑,
(1)设分别取Wg钠、镁、铝与足量的盐酸反应,在相同条件下产生氢气的体积分别为x、y、z,
2Na+2HCl=2NaCl+H2↑
46g 22.4L
Wg x
x=
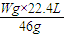 =
=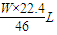 ,
,Mg+2HCl=MgCl2+H2↑
24g 22.4L
Wg y
y=
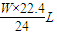 ,
,2Al+6HCl=2AlCl3+3H2↑
54g 67.2L
Wg z
z=
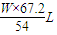 ,
,x:y:z=
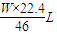 :
: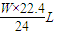 :
: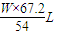 =
=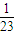 :
: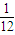 :
: ,故答案为:=
,故答案为:=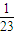 :
: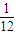 :
: ;
;(2)由反应方程式可知,
分别取0.1mol钠、镁、铝与足量的盐酸反应,在相同条件下产生氢气的体积比等于物质的量之比,为
 :1:
:1: =1:2:3,故答案为:1:2:3;
=1:2:3,故答案为:1:2:3;(3)设反应各生成1mol氢气,
则需m(Na)=46g,m(Mg)=24g,m(Al)=
 ×27g=18g,
×27g=18g,产生相同物质的量的氢气,所需钠、镁、铝的质量比为46:24:18=23:12:9,故答案为:23:12:9;
(4)由反应方程式可知,
若产生相同体积(同温同压下)的氢气,所需钠、镁、铝三种金属的物质的量之比为2mol:1mol:
 mol=6:3:2,故答案为:6:3:2;
mol=6:3:2,故答案为:6:3:2;(5)10mL 1mol/L的盐酸的物质的量为0.01L×1mol/L=0.01mol,若将0.2mol金属钠、铝、铁分别投入到10mL 1mol/L的盐酸中,可知三种金u属都过量,盐酸不足,完全反应,但金属钠能与水反应继续生成氢气,所以钠反应生成氢气最多,铝、铁反应生成氢气一样多,故答案为:Na>Al=Fe;
(6)利用差量法计算:
2Na+2H2O=2NaOH+H2↑△m
2mol 44g
0.5mol 11g
Mg+2HCl=MgCl2+H2↑△m
1mol 22g
0.5mol 11g
可知把0.5mol钠投入到m1g水(过量)中得到a溶液,把0.5mol镁投入到m2g盐酸(过量)中得到b溶液,溶液增加的质量相同,又m1=m2,则a、b质量的大小相等,
故答案为:=.
点评:本题考查化学方程式的相关计算,题目难度不大,注意金属性质的不同性以及差量法的计算应用.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目