题目内容
【题目】在1L的密闭容器中,发生3A(g)+B(g)2C(g)的反应,若最初加入A和B都是4mol,1min内,测得υ(A)=1.2mol·L﹣1·min﹣1,则此时容器中B的物质的量是
A. 1.6mol B. 2.8mol C. 3.2mol D. 3.6mol
【答案】D
【解析】
A的平均反应速率是1.2mol·L﹣1·min﹣1,则1min内A的物质的量减少△n(A)= 1.2mol·L﹣1·min﹣1×1min×1L=1.2mol,根据化学方程式计量数关系可知B减少0.4mol,则1min后容器中的B的物质的量是4mol-0.4mol=3.6mol,故D项正确。
故选D。

 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案【题目】某研究性学习小组设计实验用30mL浓硫酸与10mL无水乙醇共热制备乙烯气体、并测定乙醇转化成乙烯的转化率。已知生成的乙烯气体中含有SO2、CO2、乙醇和乙醚等杂质。有关数据如下:
熔点/℃ | 沸点/℃ | 溶解性 | 颜色状态 | 密度g/cm3 | |
乙醇 | -114.1 | 78.3 | 与水、有机溶剂互溶 | 无色液体 | 0.79 |
乙醚 | -116.2 | 34.5 | 不溶于水,易溶于有机溶剂 | 无色液体 | 0.7135 |
(1)制备乙烯

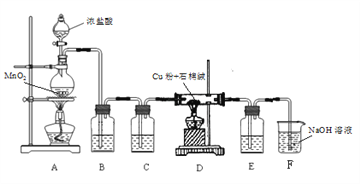
① 从A~E中选择必要的装置完成实验,并按气流方向连接的顺序为________(填仪器接口的字母编号)。
② D装置中发生反应的离子方程式_____________实验后,检验D溶液中含有CO32-的实验方案为______________。
③ E装置的主要作用是__________________。
(2)测定乙烯
反应结束后,用移液管移取C中溶液20mL(不考虑溶液体积变化)于锥形瓶中,先加入约2mL稀硫酸酸化.再用0.1000mol/L的Na2C2O4溶液滴定未反应完的KMnO4。
已知:C2H4 ![]() CO2+H2O;C2O42-
CO2+H2O;C2O42- ![]() CO2+H2O;MnO4-→Mn2+
CO2+H2O;MnO4-→Mn2+
④ 以下情况使得测定乙烯的量偏高的是(_____)
A.在用蒸馏水清洗碱式滴定管后,直接装Na2C2O4标准液
B.锥形瓶清洗干净后残有大量水珠
C.滴定前,滴定管内无气泡,滴定后有气泡
D.读数时,滴定前平视,滴定后俯视
⑤ 油定终点的现象为_______________。
⑥ 已知用去Na2C2O4溶液20.00mL,则乙醇转化成乙烯的转化率为___________。
【题目】氨是重要的化工产品之一,有着广泛的用途,运用化学反应原理的相关知识研究氨的合成及性质对工业生产有着十分重要意义。
I.合成氨用的氢气可以甲烷为原料制得:CH4(g)+H2O(g) ![]() CO(g)+3H2(g)。有关化学反应的能量变化如下图所示。CH4(g)与H2O (g)反应生成CO (g)和H2 (g)的热化学方程式为______________。
CO(g)+3H2(g)。有关化学反应的能量变化如下图所示。CH4(g)与H2O (g)反应生成CO (g)和H2 (g)的热化学方程式为______________。

II.恒温下,将一定量N2、H2置于10L的容器中发生反应:N2(g)+3H2(g)![]() 2NH3(g) △H=-92.0kJ/mol,反应过程中各物质的物质的量随时间变化如下图。
2NH3(g) △H=-92.0kJ/mol,反应过程中各物质的物质的量随时间变化如下图。

(1)图中0~2s内的反应速率v(NH3)=______;该温度下达平衡时N2的转化率为_____。
(2)若其它条件不变,将恒容条件变为恒压,则平衡时c(N2)__,平衡常数___。(填编号)
A.增大 B.减小 C.不变 D.不能确定
(3)在不同温度下达到平衡时测得NH3的体积分数如下表所示:
T/℃ | 200 | 300 | 400 |
NH3的体积分数 | a1 | a2 | 38% |
①试比较a1、a2的大小:a1_____a2(填“>”、“<”或“=”)。
②若反应在恒容400℃条件下进行,下列能判断反应达到平衡状态的依据有____ (填编号)。
A.断裂1molH-H键同时断裂2molN-H键 B.v正(N2)=3V逆(H2)
C.容器内N2、H2、NH3;的物质的量之比为1:3:2 D.平衡常数保持不变
E.混合气体的平均相对分子质量保持不变 F.混合气体的密度保持不变
(4)工业上合成氨采用了高温高压、催化剂的条件,根据反应判断下列哪些条件有利于提高氨的产率____。
A.采用400℃~500℃高温 B.采用合适的高压
C.使用铁触媒做催化剂 D.将氨液化从体系中分离出来
(5)氨气制取尿素[CO (NH2)2]的反应:2NH3 (g) +CO2(g) ![]() CO (NH2)2 (1)+H2O (g)。
CO (NH2)2 (1)+H2O (g)。
①该反应温度升高,氨气的百分含量增大,则△H______0(填“>”、“<”或“=”)。
②CO的平衡转化率与温度、压强的关系如图所示, 若充入2mol NH3与1mol CO2在2L密闭容器中进行反应,则100℃时反应的平衡常数K=________;压强的大小关系:P1______P2(填“>”、“<”、“=”或“不确定”)。