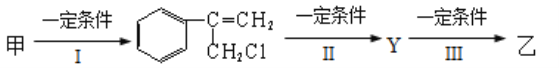题目内容
【题目】A、B、C、D、E、X均为短周期元素形成的无机物,存在如图所示转化关系(部分生成物和反应条件略去);已知A 由短周期非金属元素组成,B具有漂白性且光照易分解。请回答以下问题:
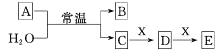
(1)若A为单质,且C为一元强酸。
①化合物B 的结构式为_______。
②写出一种工业制备单质A的离子方程式:________。
③X可能为______(填字母代号)。
a.NaOH b.AlCl3 c.Na2CO3 d.Na[Al(OH)4]
(2)若A为两种元素形成的化合物,且E与水反应生成的G的浓溶液遇C有白烟产生。
①A的电子式为______。
②A与H2O反应的化学方程式为_____。
③室温下,NH2OH(羟氨)会发生分解生成C、D,试写出其分解反应的化学方程式_________。
【答案】H—O—Cl 2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑ cd
2OH-+H2↑+Cl2↑ cd 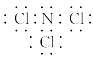 NCl3+3H2O=3HClO+NH3 5NH2OH=3NH3↑+2NO↑+3H2O
NCl3+3H2O=3HClO+NH3 5NH2OH=3NH3↑+2NO↑+3H2O
【解析】
A、B、C、D、E、X均为短周期元素形成的无机物,A由短周期非金属元素组成,B具有漂白性且光照易分解,则B为HClO;
(1)若A为单质,且C为一元强酸,则C为HCl,A为Cl2,X可能为Na2CO3、Na[Al(OH)4]等;
(2)若A为两种元素形成的化合物,且E与水反应生成G的浓溶液遇C有白烟产生,则C为NH3,结合B为HClO,根据元素守恒可及化合价的情况可知A为NCl3,时而推得G为HNO3,E为NO2,X为氧气,符合转化关系,以此解答该题。
A、B、C、D、E、X均为短周期元素形成的无机物,A由短周期非金属元素组成,B具有漂白性且光照易分解,则B为HClO。
(1)若A为单质,C为一元强酸,则C为HCl,A为Cl2;
①化合物B为HClO,结构式为H—O—Cl。
②工业上电解饱和食盐水制备Cl2,工业制备单质A的离子方程式:2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑。
2OH-+H2↑+Cl2↑。
③a.若X为NaOH,NaOH与HCl反应生成的NaCl与NaOH不反应,X不可能为NaOH;b.若X为AlCl3,AlCl3与HCl不反应,X不可能为AlCl3,c.若X为Na2CO3,Na2CO3与HCl反应生成CO2,CO2与Na2CO3、H2O反应生成NaHCO3,X可能为Na2CO3;d.若X为Na[Al(OH)4],Na[Al(OH)4]与过量HCl反应生成AlCl3,AlCl3与Na[Al(OH)4]反应生成Al(OH)3,X可能为Na[Al(OH)4];答案选cd。
(2)若A为两种元素形成的化合物,且E与水反应生成G的浓溶液遇C有白烟产生,则C为NH3,结合B为HClO,根据元素守恒定律及化合价的情况可知A为NCl3,推得G为HNO3,D为NO,E为NO2,X为氧气。
①A的电子式为
②A与H2O反应的化学方程式为NCl3+3H2O=3HClO+NH3。
③室温下,NH2OH(羟氨)会发生分解生成C、D,其分解反应的化学方程式为5NH2OH=3NH3↑+2NO↑+3H2O。