题目内容
硫元素的含氧酸盐在工业上用途广泛,完成下列填空。
工业上用Na2SO3溶液处理工业尾气中的SO2,下表数据表示反应过程中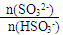 随pH变化的关系:
随pH变化的关系:
|
|
91:9 |
1:1 |
9:91 |
|
室温下pH |
8.2 |
7.2 |
6.2 |
(1)简述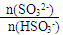 = 1时,溶液pH= 7.2的原因:___________________;若用0.20 mol/L 的NaOH溶液(反应前后溶液体积不变)吸收SO2,若反应后溶液呈中性,则
= 1时,溶液pH= 7.2的原因:___________________;若用0.20 mol/L 的NaOH溶液(反应前后溶液体积不变)吸收SO2,若反应后溶液呈中性,则
c (HSO3-) + 2c (SO32-) = _______ mol/L 。
(2)已知:Ki1(H2SO3)> Ki(HAc) > Ki2(H2SO3) > Ki2(H2CO3),要使NaHSO3溶液中c(Na+):c(HSO3-)接近1:1,可在溶液中加入少量____________。
a.H2SO3溶液 b.NaOH溶液 c.冰醋酸 d.Na2CO3
(3)实验室通过低温电解KHSO4溶液制备过二硫酸钾K2S2O8,写出熔融KHSO4的电离方程式:__________________________________________。
(4)S2O82-有强氧化性,还原产物为SO42-,硫酸锰(MnSO4)和过硫酸钾(K2S2O8)两种盐溶液在银离子催化下可发生反应,得到紫红色溶液。书写此反应的化学方程式: 。
(5)已知:S2O32-有较强的还原性,实验室可用I-测定K2S2O8样品的纯度:反应方程式为:
S2O82-+2I-→2SO42-+I2 ……① I2+2S2O32-→2I-+S4O62- ……②
S2O82-、S4O62-、I2氧化性强弱顺序:__________________________。
(6)K2S2O8是偏氟乙烯(CH2=CF2)聚合的引发剂,偏氟乙烯由CH3—CClF2气体脱去HCl制得,生成0.5 mol偏氟乙烯气体要吸收54 kJ的热,写出反应的热化学方程式_______。
(1)HSO3-的电离程度与SO32-的水解程度相近(1分) 0.2 mol/L(2分)
(2) a c(2分)
(3)KHSO4 →K+ + HSO4- (1分)
(4)5K2S2O8 + 2MnSO4 + 8H2O → 4K2SO4 + 2KMnO4 + 8H2SO4(2分)
(5)S2O82- > I2 > S4O62- (2分)
(6)CH3—CClF2(g) → CH2=CF2(g) + HCl(g)–108kJ(2分)
【解析】
试题分析:(1)简述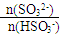 = 1时,溶液pH= 7.2的原因HSO3-的电离程度与SO32-的水解程度相近,此时溶液接近中性;根据电荷守恒,若用0.20 mol/L 的NaOH溶液(反应前后溶液体积不变)吸收SO2,若反应后溶液呈中性,则c (HSO3-)
+ 2c (SO32-) =c (Na+)= 0.2 mol/Lmol/L 。
= 1时,溶液pH= 7.2的原因HSO3-的电离程度与SO32-的水解程度相近,此时溶液接近中性;根据电荷守恒,若用0.20 mol/L 的NaOH溶液(反应前后溶液体积不变)吸收SO2,若反应后溶液呈中性,则c (HSO3-)
+ 2c (SO32-) =c (Na+)= 0.2 mol/Lmol/L 。
(2)已知:Ki1(H2SO3)> Ki(HAc) > Ki2(H2SO3) > Ki2(H2CO3),要使NaHSO3溶液中c(Na+):c(HSO3-)接近1:1,从信息中可以看出,亚硫酸氢根电离程度大于其水解程度,故只要抑制其电离即可,可在溶液中加入少量a.H2SO3溶液和c.冰醋酸。
(3)KHSO4电离出钾离子和硫酸氢根,熔融KHSO4的电离方程式KHSO4 →K+ + HSO4- 。
(4)得到紫红色溶液应该是高锰酸钾,再根据氧化还原原理书写此反应的化学方程式为5K2S2O8 + 2MnSO4 + 8H2O → 4K2SO4 + 2KMnO4 + 8H2SO4。
(5)根据氧化剂的氧化性大于氧化产物的氧化性规律,可推测为S2O82-+2I-→2SO42-+I2 ……①,可得出 S2O82- > I2 。再通过反应 I2+2S2O32-→2I-+S4O62- ……②可得出 I2 > S4O62- 。故 S2O82-、S4O62-、I2氧化性强弱顺序:S2O82- > I2 > S4O62- 。
(6)根据热化学方程式的书写方法,写出CH3—CClF2(g) → CH2=CF2(g) + HCl(g)–108kJ。
考点:本题考查电离平衡常数的运用,盐类的水解,氧化性强弱比较,热方程式的书写。

 智慧小复习系列答案
智慧小复习系列答案(1)工业上用Na2SO3溶液处理工业尾气中的SO2,表中数据表示反应过程中
| n(SO32-) |
| n(HSO3-) |
|
91:9 | 1:1 | 9:91 | ||
| 室温下pH | 8.2 | 7.2 | 6.2 |
| n(SO32-) |
| n(HSO3-) |
(2)已知Ki1(H2SO3)>Ki(HAc)>Ki2(H2SO3)>Ki2(H2CO3),要使NaHSO3溶液中c(Na+):c(HSO3-)接近1:1,可在溶液中加入少量
a.H2SO3溶液 b.NaOH溶液 c.冰醋酸 d.Na2CO3
(3)实验室通过低温电解KHSO4溶液制备过二硫酸钾K2S2O8,写出熔融KHSO4的电离方程式:
(4)S2O82-有强氧化性,还原产物为SO42-,硫酸锰(MnSO4)和过硫酸钾(K2S2O8)两种盐溶液在银离子催化下可发生反应,得到紫红色溶液.书写此反应的化学方程式:
(5)已知:S2O32-有较强的还原性,实验室可用I-测定K2S2O8样品的纯度:反应方程式为:
S2O82-+2I-→2SO42-+I2 …①;
I2+2S2O32-→2I-+S4O62-…②.
则S2O82-、S4O62-、I2氧化性强弱顺序:
(6)K2S2O8是偏氟乙烯(CH2=CF2)聚合的引发剂,偏氟乙烯由CH3-CClF2气体脱去HCl制得,生成0.5mol偏氟乙烯气体要吸收54kJ的热,写出反应的热化学方程式