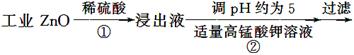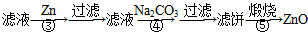题目内容
废旧碱性锌锰干电池内部的黑色物质A主要含有MnO2、NH4CI、ZnCI2,还有少量的FeCI2和炭粉,用A制备高纯MnCO3,的流程图如下。
(1)碱性锌锰干电池的负极材料是_________(填化学式)。
(2)第Ⅱ步操作的目的是________________________。
(3)第Ⅳ步操作是对滤液a进行深度除杂,除去Zn2+的离子方程式为____________________。 (已知:Ksp(MnS)=2.5×10-13,Ksp(ZnS)=1.6×10-24)
(4)为选择试剂X,在相同条件下,分别用5 g黑色物质M进行制备MnSO4的实验,得到数据如右表:
①试剂x的最佳选择是_________。
②第Ⅲ步中用选出的最佳试剂X与M的
主要成分反应的化学方程式为_________。
(5)第V步系列操作可按以下流程进行:
已知:MaCO3难溶于水和乙醇,潮湿时易被空气氧化,100℃开始分解;Mn(OH) 2开
始沉淀时pH为7.7。请补充完成以下操作:
操作1:___________________;操作2:过滤,用少量水洗涤2~3次
操作3:检测滤液,表明SO 已除干净; 操作4:___________________;
已除干净; 操作4:___________________;
操作5:低温烘干。
(1)Zn
(2)除去碳和氯化铵
(3)Zn2++MnS= Zn2++MnS+Mn2+
(4)①30%过氧化氢 ②MnO2+H2O2+H2SO4= MnSO4+2H2O+O2↑
(5)加入碳酸钠,控制pH小于7.7
用少量无水乙醇洗涤2——3次
解析试题分析:(1)锌是活泼金属,电池反应中失去电子为负极;(2)加热灼烧碳生成二氧化碳除去,氯化铵分解除去,所以加热的目的是除去碳和氯化铵;(3)该反应是沉淀的转化,沉淀向溶度积小的物质转化,根据溶度积常数MnS不溶, ZnS更难溶;(4)①相同量的M实验4制备得到MnSO4的量最多,所以选用双氧水实验效果做好;②二氧化锰生成硫酸锰,化合价降低为氧化剂,所以双氧水为还原剂产物为氧气,MnO2+H2O2+H2SO4= MnSO4+2H2O+O2↑;(5)反应是制备碳酸锰,所以应加入碳酸钠等可溶性碳酸盐或碳酸氢盐,并调节pH小于7.7(防止生成氢氧化锰),生成碳酸锰,用水洗涤后沉淀表面有水在干燥时易被空气氧化,沉淀不溶于乙醇,且乙醇易挥发易于干燥,所以采用乙醇冲洗除去沉淀表面的水,一般操作2——3次。
考点:考查实验操作与原理有关问题。

有一无色透明溶液,欲确定是否含有下列离子: Fe2+、Mg2+、Al3+、Ba2+、NO3-、SO42-、Cl-、I-、HCO3-,取该溶液进行实验:
| 实验步骤 | 实验现象 |
| (1)取少量该溶液,加几滴紫色石蕊试液 | 溶液变红 |
| (2)取少量该溶液加热,加Cu片和浓H2SO4,加热 | 有无色气体产生,气体遇空气变成红棕色 |
| (3)取少量该溶液,加BaCl2溶液 | 有白色沉淀 |
| (4)取(3)中上层清液,加AgNO3溶液 | 有白色沉淀,且不溶于稀HNO3 |
| (5)取少量该溶液,加NaOH溶液 | 有白色沉淀,NaOH过量时沉淀部分溶解 |
由此判断:
(1)溶液中肯定不存在的离子有________,溶液中肯定存在的离子是____。
(2)请设计实验验证其中可能存在的阴离子的方法(写明操作、现象、结论)_____。
二氧化锰可用作干电池去极剂,合成工业的催化剂和氧化剂,玻璃工业和搪瓷工业的着色剂、消色剂、脱铁剂等。
(1)二氧化锰在酸性介质中是一种强氧化剂,请用化学方程式证明:______________________。
(2)锌—锰碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。电池的总反应式为Zn(s)+2MnO2(s)+H2O(l)=Zn(OH)2(s)+Mn2O3(s)。
①电池工作时,MnO2发生________反应。
②电池的正极反应式为________。
(3)工业上以软锰矿为原料,利用硫酸亚铁制备高纯二氧化锰的流程如下: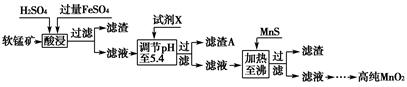
已知:软锰矿的主要成分为MnO2,还含Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物,部分阳离子以氢氧化物或硫化物的形式完全沉淀时溶液的pH见下表。
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Cu(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 10.4 | 6.7 |
| 沉淀物 | Zn(OH)2 | CuS | ZnS | MnS | FeS |
| pH | 8.0 | -0.42 | 2.5 | 7 | 7 |
回答下列问题:
①硫酸亚铁在酸性条件下将MnO2还原为MnSO4,酸浸时发生的主要反应的化学方程式为________________________。
②试剂X为________。
③滤渣A的主要成分为________。
④加入MnS的目的主要是除去溶液中的________。
工业利用精炼镁渣(含有MgO、KCl、MgCl2、BaCl2、CaCl2、FeCl3等杂质)回收MgCl2的工业流程如下:
已知:25 ℃时有关物质的溶度积如下:
| 物质 | CaCO3 | MgCO3 | BaCO3 | Mg(OH)2 | Fe(OH)3 |
| Ksp | 4.96×10-9 | 6.82×10-6 | 5.1×10-9 | 5.61×10-12 | 2.64×10-38 |
(1)写出溶解时的离子方程式 。
(2)溶解时温度不能太高,也不宜太低,要求控制在35 ℃左右,其理由是 。
(3)操作Ⅰ包含多个操作,分别为 ,过滤,洗涤,烘干。烘干时需要减压烘干,原因是 。
(4)为减少Na2CO3的用量和提高产品质量,在中和工序(中和后溶液接近中性)结束前要检验溶液中是否存在 离子,选择检验该离子的原因是 。
(5)母液的主要成分 。

 2RAn(有机层)+nH2SO4(水层),
2RAn(有机层)+nH2SO4(水层),