题目内容
一定量的C3H8燃烧后得到的产物是CO、CO2、H2O(g),此混合物的质量为17.2 g,当其缓缓通过足量的无水CaCl2时气体质量减少为10.0 g,则混合气中CO的质量为( )A.10.0 g B.14.4 g C.5.6 g D.7.2 g
解析:由题意,生成水的质量为17.2 g-10.0 g=7.2 g;生成碳氧化物的质量为:10.0 g。即m(H2O)=7.2 g;m(CO2)+m(CO)=10.0 g。
本题有多种解法。
方法1(列方程法):设产物中CO的物质的量为x,CO2的物质的量为y,由C原子守恒可得C3H8的物质的量为(x+y)/3,C3H8和H2O的物质的量关系为:
C3H8 — 4H2O
1 mol 4 mol
(x+y)/3 4(x+y)/3
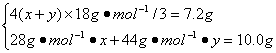
解得:x=0.20 mol,y=0.10 mol
m(CO)=0.20 mol×28 g·mol-1=5.6 g
方法2(十字相乘法):由题意:
n(H2O)=![]() =0.40 mol
=0.40 mol
由C、H原子守恒得:
n(CO2)+n(CO)=3n(C3H8)=3n(H2O)/4=3×0.40 mol/4=0.30 mol
若0.10 mol C3H8完全生成CO,其质量为3×0.10 mol×28 g·mol-1=8.4 g;若0.10 mol C3H8完全生成CO2,其质量为3×0.10 mol×44 g·mol-1=13.2 g。则:

n(CO)∶n(CO2)=2∶1
m(CO)=28 g·mol-1×0.30 mol×2/3=5.6 g。
答案:C

(14分)丙烷在燃烧时能放出大量的热,它也是液化石油气的主要成分,作为能源应用于人们的日常生产和生活。
已知:①2C3H8(g)+7O2(g)=6CO(g)+8H2O(l);△H=-2741.8kJ/mol
②2CO(g)+O2(g)=2CO2(g) ΔH="-566" kJ/mol
(1)反应C3H8(g)+5O2(g)=3CO2(g)+4H2O(l)的△H=
(2)C3H8在不足量的氧气里燃烧,生成CO和CO2以及气态水,将所有的产物通入一个固定体积的密闭容器中,在一定条件下发生如下可逆反应:
CO (g)+H2O(g) CO2(g)+H2 (g)
CO2(g)+H2 (g)
①下列事实能说明该反应达到平衡的是
a.体系中的压强不发生变化 b.υ正(H2)=υ逆(CO)
c.混合气体的平均相对分子质量不发生变化 d.CO2的浓度不再发生变化
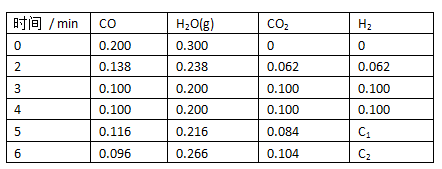
② T℃时,在一定体积的容器中,通入一定量的CO(g)和H2O(g),发生反应并保持温度不变,各物质浓度随时间变化如下表:
| 时间 / min | CO | H2O(g) | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | 0.100 | 0.200 | 0.100 | 0.100 |
| 4 | 0.100 | 0.200 | 0.100 | 0.100 |
| 5 | 0.116 | 0.216 | 0.084 | C1 |
| 6 | 0.096 | 0.266 | 0.104 | C2 |
已知420℃时,该化学反应的平衡常数为9。如果反应开始时,CO和H2O(g)的浓度都是0.01 mol/L,则CO在此条件下的转化率为 。又知397℃时该反应的平衡常数为12,请判断该反应的△H 0 (填“>”、“=”、“<”).
(3)依据(1)中的反应可以设计一种新型燃料电池,一极通入空气,另一极通入丙烷气体;
燃料电池内部是熔融的掺杂着氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在其内部可以传导O2—。在电池内部O2—移向_ ___极(填“正”或“负”);电池的负极反应式为 。
(4)用上述燃料电池用惰性电极电解足量Mg(NO3)2和NaCl的混合溶液。电解开始后阴极的现象为____ 。
(14分)丙烷在燃烧时能放出大量的热,它也是液化石油气的主要成分,作为能源应用于人们的日常生产和生活。
已知:①2C3H8(g)+7O2(g)=6CO(g)+8H2O(l);△H=-2741.8kJ/mol
②2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ/mol
(1)反应C3H8(g)+5O2(g)=3CO2(g)+4H2O(l)的△H=
(2)C3H8在不足量的氧气里燃烧,生成CO和CO2以及气态水,将所有的产物通入一个固定体积的密闭容器中,在一定条件下发生如下可逆反应:
CO (g)+H2O(g)
 CO2(g) +H2 (g)
CO2(g) +H2 (g)
①下列事实能说明该反应达到平衡的是
a.体系中的压强不发生变化 b.υ正(H2)=υ逆(CO )
c.混合气体的平均相对分子质量不发生变化 d.CO2的浓度不再发生变化
② T℃时,在一定体积的容器中,通入一定量的CO(g)和H2O(g),发生反应并保持温度不变,各物质浓度随时间变化如下表:
|
时间 / min |
CO |
H2O(g) |
CO2 |
H2 |
|
0 |
0.200 |
0.300 |
0 |
0 |
|
2 |
0.138 |
0.238 |
0.062 |
0.062 |
|
3 |
0.100 |
0.200 |
0.100 |
0.100 |
|
4 |
0.100 |
0.200 |
0.100 |
0.100 |
|
5 |
0.116 |
0.216 |
0.084 |
C1 |
|
6 |
0.096 |
0.266 |
0.104 |
C2 |
第5、6min时的数据是保持温度和体积不变时,改变某一条件后测得的。则第4~5min之间,改变的条件 ,第5~6min之间,改变的条件是 。
已知420℃时,该化学反应的平衡常数为9。如果反应开始时,CO和H2O(g)的浓度都是0.01 mol/L,则CO在此条件下的转化率为 。又知397℃时该反应的平衡常数为12,请判断该反应的△H 0 (填“>”、“=”、“<”).
(3)依据(1)中的反应可以设计一种新型燃料电池,一极通入空气,另一极通入丙烷气体;
燃料电池内部是熔融的掺杂着氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在其内部可以传导O2—。在电池内部O2—移向_ ___极(填“正”或“负”);电池的负极反应式为 。
(4)用上述燃料电池用惰性电极电解足量Mg(NO3)2和NaCl的混合溶液。电解开始后阴极的现象为____ 。
 (1)盖斯定律认为:不管化学过程是一步完成或分数步完成,整个过程的总
(1)盖斯定律认为:不管化学过程是一步完成或分数步完成,整个过程的总 CO2(g) +H2 (g)
CO2(g) +H2 (g)