题目内容
【题目】氯苯在染料、医药工业中用于制造苯酚、硝基氯苯、苯胺、硝基酚等有机中间体。实验室中制备氯苯的装置如图所示(夹持仪器已略去)。请回答下列问题:
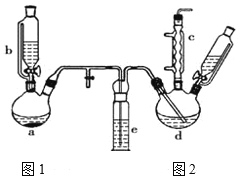
(1)仪器a中盛有KMnO4晶体,仪器b中盛有浓盐酸。打开仪器a中的活塞,使浓盐酸缓缓滴下,仪器中产生黄绿色气体,用离子方程式表示产生该现象的原因:____。
(2)仪器b中细玻璃导管的作用是_____。
(3)仪器d内盛有苯、FeCl3粉末,仪器a中生成的气体经过仪器e进入到仪器d中。
①仪器e的名称是洗气瓶,内盛装的试剂是____;
②仪器d中的反应进行过程中,保持温度在40-60℃,以减少副反应发生。仪器d的加热方式最好采用___加热。
(4)仪器c的作用是___;d中发生的化学反应方程式是____。
(5)该方法制备的氯苯中含有很多杂质,工业生产中通过水洗,然后通过碱洗,再水洗,最后通过分液得到含氯苯的有机物的混合物,混合物成分及沸点如图2表格所示:
有机物 | 苯 | 氯苯 | 邻二氯苯 | 间二氯苯 | 对二氯苯 |
沸点/℃ | 80 | 132.2 | 180.4 | 173.0 | 174.1 |
①碱洗前先进行水洗的目的是____;
②取该有机物的混合物中的氯苯时,采用蒸馏的方法,收集___℃左右的馏分。
【答案】2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O 平衡气压,便于液体顺利滴下 浓硫酸 水浴加热 冷凝、回流 ![]() +Cl2
+Cl2 ![]()
 +HCl 洗去混合物中的FeCl3、HCl及部分Cl2 132.2
+HCl 洗去混合物中的FeCl3、HCl及部分Cl2 132.2
【解析】
(1)仪器a中盛有KMnO4晶体,仪器b中盛有浓盐酸,发生反应生成Cl2,反应离子方程式为2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O,氯气为黄绿色气体;
答案为:2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O;
(2)仪器b外侧玻璃导管的作用是平衡仪器a、b内的气压,使浓盐酸顺利滴下;
答案为:平衡气压,便于液体顺利滴下;
(3)①仪器e的名称是洗气瓶,图1中产生Cl2中混有HCl和水蒸气,HCl对氯苯的制备无影响,因此仪器e的目的是除去Cl2中水蒸气,即仪器e中盛放浓硫酸;
答案为:浓硫酸;
②仪器d中的反应进行过程中,保持温度在40℃~60℃,为了受热均匀便于控制温度,选择水浴加热;
答案为:水浴加热;
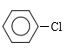
(4)仪器c的作用是冷凝回流;d中发生取代反应,其反应方程式为![]() +Cl2
+Cl2 ![]()
 +HCl;
+HCl;
答案为:冷凝、回流;![]() +Cl2
+Cl2 ![]()
 +HCl;
+HCl;
(5)①碱洗前进行水洗的目的是洗去酸性物质,节约后续碱洗操作时碱的用量,减少生产成本;
答案为:洗去混合物中的FeCl3、HCl及部分Cl2;
②由图表可以知道,氯苯的沸点为132.2℃,因此收集的是132.2℃的馏分;
答案为:132.2。

 阅读快车系列答案
阅读快车系列答案