题目内容
苯酚具有弱酸性,在空气中易被氧化。工业上以苯、硫酸、氢氧化钠、亚硫酸钠为原料合成苯酚的方法可简单表示为:

(1)根据上述反应判断下列三种物质的酸性由强到弱的顺序为 (填序号)。
A.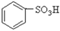 B.
B. C.H2SO3
C.H2SO3
(2)步骤④与使用CO2相比,使用SO2的优点是 (答一个方面)。
(3)经反应④得到的产物除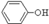 外、可能还含有OH-、SO32-、HSO3-等微粒。请设计实验方案,证明溶液中存在
外、可能还含有OH-、SO32-、HSO3-等微粒。请设计实验方案,证明溶液中存在 、SO32-、HSO3-,写出实验步骤、预期现象和结论。
、SO32-、HSO3-,写出实验步骤、预期现象和结论。
限选仪器及试剂:试管、滴管、玻璃棒、过滤装置和滤纸;2mol·L-1盐酸、1mol·L-1 BaCl2溶液、品红溶液、0.01 mol·L-1酸性KMnO4溶液、1 mol·L-1 FeCl3溶液、饱和溴水等。
|
实验步骤 |
预期现象和结论 |
|
步骤1:取少量待测液于试管中,加入足量的1 mol·L-1BaCl2溶液,静置、过滤,得滤液和沉淀。将滤液分置于试管A、B中,沉淀置于试管C中。 |
|
|
步骤2:往试管A中加入 。 |
,说明溶液中含有HSO3-。 |
|
步骤3:往试管B中加入 。 |
。 |
|
步骤4:往试管C中加入2 mol·L-1盐酸酸化,再滴入1~2滴品红溶液。 |
,说明溶液中含有SO32-。 |
(4)纯度测定:称取1.00g产品溶解于足量温水中,向其中加入足量饱和溴水(产品中除苯酚外,不含其它与饱和溴水反应生成沉淀的物质),苯酚全部生成三溴苯酚沉淀,经过滤、洗涤、干燥后,称得沉淀质量为3.31g,则产品中苯酚的质量分数为 。(苯酚的分子式为C6H6O,三溴苯酚的分子式为C6H3Br3O,它们的相对分子质量分别为94、331)
(16分)(1)A>C>B (3分)
(2)使用SO2可防止 被氧化(或SO2可利用工业废气获得,变废为宝。其它合理答案也给分)(2分)
被氧化(或SO2可利用工业废气获得,变废为宝。其它合理答案也给分)(2分)
(3)(8分)方案一:
|
实验步骤 |
预期现象和结论 |
|
步骤2:往试管A中加入 足量2 mol·L-1盐酸酸化,(1分)再滴入1~2滴品红溶液(1分)。 |
品红溶液褪色(1分) ,说明溶液中含有HSO3-。 |
|
步骤3:往试管B中加入 几滴FeCl3溶液(1分) 。 |
溶液显紫色(1分),说明溶液中含有 |
|
|
沉淀溶解(1分),品红溶液褪色(1分) ,说明溶液中含有SO32-。 |
评分说明:步骤2若用0.01 mol·L-1酸性KMnO4溶液,因 有还原性,也能使酸性KMnO4溶液褪色,对应得分点不给分;步骤3改为“足量饱和溴水”、“溶液中产生白色沉淀”也给分,试剂用量错误或无说明合扣1分。
有还原性,也能使酸性KMnO4溶液褪色,对应得分点不给分;步骤3改为“足量饱和溴水”、“溶液中产生白色沉淀”也给分,试剂用量错误或无说明合扣1分。
(4)94.0% (3分,有效数字错扣1分)
【解析】
试题分析:(1)反应②能自发进行,即2C6H5SO3H+Na2SO3→2C6H5SO3Na+SO2↑+H2O,说明苯磺酸的酸性比亚硫酸强;反应④能自发进行,即SO2+H2O+2C6H5ONa→2C6H5OH+Na2SO3,说明亚硫酸的酸性比苯酚强;综上所述,酸性:苯磺酸>亚硫酸>苯酚,故酸性由强到弱的顺序:A>C>B;(2)使用二氧化碳、二氧化硫分别制备苯酚的原理是:CO2+H2O+C6H5ONa→C6H5OH+NaHCO3、SO2+H2O+2C6H5ONa→2C6H5OH+Na2SO3(或者SO2+H2O+C6H5ONa→C6H5OH+NaHSO3),前者反应生成的碳酸氢钠没有还原性,对苯酚无保护作用,而后者生成的亚硫酸钠(或亚硫酸氢钠)、苯酚都具有还原性,都可以被空气中的氧气氧化,且亚硫酸钠(或亚硫酸氢钠)的还原性比苯酚强,优先被氧气氧化为硫酸钠,因此使用SO2制备的苯酚中混有的亚硫酸钠(或亚硫酸氢钠)可以防止 被氧化(或SO2可利用工业废气获得,变废为宝);(3)根据苯酚、亚硫酸根离子和亚硫酸氢根离子的性质,步骤1中发生的反应可能是Ba2++SO32—=BaSO3↓,所得滤液中可能含有亚硫酸氢根离子、苯酚,一定含有钡离子和氯离子,滤渣的主要成分可能是亚硫酸钡;由于亚硫酸氢根离子具有两性和还原性,但题目限选试剂中没有强碱,只能选择盐酸和品红溶液检验其存在,若往试管A中加入足量2mol/L盐酸酸化,再滴入几滴(或少量)品红溶液,品红溶液褪色或产生有刺激性气味气体,说明溶液中含有HSO3—;不能利用HSO3—的还原性检验,因为苯酚、HSO3—都具有还原性,苯酚会干扰HSO3—的检验,往试管A中加入0.01mol/L酸性高锰酸钾溶液,紫红色溶液褪色,不能说明溶液中含有HSO3—;步骤3中可以根据苯酚与浓溴水的取代反应或与氯化铁溶液的显色反应检验,往试管B中加入几滴1mol/LFeCl3溶液,溶液变为紫色,说明溶液中含有苯酚;或者往试管B中加入几滴饱和溴水,产生白色沉淀,说明溶液中含有苯酚;步骤4中反应可能是BaSO3+2HCl=BaCl2+SO2↑+H2O,二氧化硫具有漂白性,能使品红溶液褪色,说明溶液中含有SO32—;(4)由于三溴苯酚的相对分子质量为331,n=m/M,则三溴苯酚的物质的量为0.0100mol;由于取代反应中苯酚与三溴苯酚的系数之比等于物质的量之比,则苯酚的物质的量也是0.0100mol;由于苯酚的相对分子质量为94,m=n•M,则参加反应的苯酚的质量为0.940g;由于苯酚产品的质量为1.00g,其中苯酚的质量为0.940g,则产品中苯酚的质量分数为0.940/1.00×100%=94.0%,注意计算过程中均保留三位有效数字。
被氧化(或SO2可利用工业废气获得,变废为宝);(3)根据苯酚、亚硫酸根离子和亚硫酸氢根离子的性质,步骤1中发生的反应可能是Ba2++SO32—=BaSO3↓,所得滤液中可能含有亚硫酸氢根离子、苯酚,一定含有钡离子和氯离子,滤渣的主要成分可能是亚硫酸钡;由于亚硫酸氢根离子具有两性和还原性,但题目限选试剂中没有强碱,只能选择盐酸和品红溶液检验其存在,若往试管A中加入足量2mol/L盐酸酸化,再滴入几滴(或少量)品红溶液,品红溶液褪色或产生有刺激性气味气体,说明溶液中含有HSO3—;不能利用HSO3—的还原性检验,因为苯酚、HSO3—都具有还原性,苯酚会干扰HSO3—的检验,往试管A中加入0.01mol/L酸性高锰酸钾溶液,紫红色溶液褪色,不能说明溶液中含有HSO3—;步骤3中可以根据苯酚与浓溴水的取代反应或与氯化铁溶液的显色反应检验,往试管B中加入几滴1mol/LFeCl3溶液,溶液变为紫色,说明溶液中含有苯酚;或者往试管B中加入几滴饱和溴水,产生白色沉淀,说明溶液中含有苯酚;步骤4中反应可能是BaSO3+2HCl=BaCl2+SO2↑+H2O,二氧化硫具有漂白性,能使品红溶液褪色,说明溶液中含有SO32—;(4)由于三溴苯酚的相对分子质量为331,n=m/M,则三溴苯酚的物质的量为0.0100mol;由于取代反应中苯酚与三溴苯酚的系数之比等于物质的量之比,则苯酚的物质的量也是0.0100mol;由于苯酚的相对分子质量为94,m=n•M,则参加反应的苯酚的质量为0.940g;由于苯酚产品的质量为1.00g,其中苯酚的质量为0.940g,则产品中苯酚的质量分数为0.940/1.00×100%=94.0%,注意计算过程中均保留三位有效数字。
考点:考查探究实验及化学计算,涉及较强酸制较弱酸的复分解反应、比较酸性的强弱顺序、评价用二氧化硫制备苯酚比用二氧化碳制备苯酚的优点、化学方程式、设计实验方案检验苯酚产品中的SO32—和HSO3—、设计实验方案检验产品中苯酚的存在、利用苯酚的沉淀反应测定产品的纯度、三溴苯酚沉淀的质量、物质的量、物质的量在化学方程式中的应用、苯酚的质量和纯度计算、有效数字的处理等。

 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案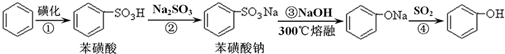
(1)根据上述反应判断下列三种物质的酸性由强到弱的顺序为
A.
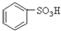 B.
B.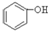 C.H2SO3
C.H2SO3(2)步骤④与使用CO2相比,使用SO2的优点是
(3)经反应④得到的产物除
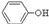 外、可能还含有OH-、S
外、可能还含有OH-、S| O | 2- 3 |
| O | - 3 |
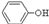 、S
、S| O | 2- 3 |
| O | - 3 |
限选仪器及试剂:试管、滴管、玻璃棒、过滤装置和滤纸;2mol?L-1盐酸、1mol?L-1 BaCl2溶液、品红溶液、0.01mol?L-1酸性KMnO4溶液、1mol?L-1FeCl3溶液、饱和溴水等.
| 实验步骤 | 预期现象和结论 | ||
| 步骤1:取少量待测液于试管中,加入足量的1mol?L-1BaCl2溶液,静置、过滤,得滤液和沉淀.将滤液分置于试管A、B中,沉淀置于试管C中. | |||
| 步骤2:往试管A中加入 |
| ||
| 步骤3:往试管B中加入 |
|||
| 步骤4:往试管C中加入2mol?L-1盐酸酸化,再滴入1~2滴品红溶液. |
|

 如图所示实验室制取酚醛树脂的装置,按要求填写下列空白:
如图所示实验室制取酚醛树脂的装置,按要求填写下列空白: