题目内容
目前,“低碳经济”备受关注,CO2的产生及有效开发利用成为科学家研究的重要课题。试运用所学知识,解决下列问题:
(1)已知某反应的平衡表达式为: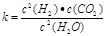 它所对应的化学反应为:__ ___
它所对应的化学反应为:__ ___
(2)—定条件下,将C(s)和H2O(g)分别加入甲、乙两个密闭容器中,发生(1)中反应:其相关数据如下表所示:
| 容器 | 容积/L | 温度/℃ | 起始量/mol | 平衡量/mol[ | 达到平衡所需时间/min | |
| C(s) | H2O(g) | H2(g) | ||||
| 甲 | 2 | T1 | 2 | 4 | 3.2 | 8 |
| 乙 | 1 | T2 | 1 | 2 | 1,2 | 3 |
①T10C时,该反应的平衡常数K=_______
②乙容器中,当反应进行到1.5min时,H2O(g)的物质的量浓度_______ (填选项字母)。
A.="0.8" mol·L-1 B.=1.4 mol·L-1 C.<1.4 mol·L-1 D.>1.4 mol·L-1
③丙容器的容积为1L,T1℃时,按下列配比充入C(s)、H2O(g)、CO2(g)和H2(g), 达到平 衡时各气体的体积分数与甲容器完全相同的是_______(填选项字母)。
A.0.6 mol、1.0 mol、0.5 mol、1.0 mol
B. 0.6 mol、2.0 mol、0 mol、0 mol
C.1.0 mol、2.0 mol、1.0 mol、2.0 mol
D. 0.25 mol、0.5 mol、0.75 mol、1.5 mol
(3)在一定条件下,科学家利用从烟道气中分离出CO2与太阳能电池电解水产生的H2合成甲醇,已知CH3OH、H2的燃烧热分别为:△H=-725.5kJ/mol、△H=-285.8kJ/mol,写出工业上以CO2、H2合成CH3OH的热化学方程式: 。
(4)将燃煤废气中的CO2转化为甲醚的反应原理为:
2CO2(g)+ 6H2(g)
 CH3OCH3(g)+ 3H2O(g)
CH3OCH3(g)+ 3H2O(g)已知一定压强下,该反应在不同温度、不同投料比时,CO2的转化率见下表:
| 投料比[n(H2)/ n(CO2)] | 500 K | 600 K | 700 K | 800 K |
| 1.5 | 45% | 33% | 20% | 12% |
| 2.0 | 60% | 43% | 28% | 15% |
| 3.0 | 83% | 62% | 37% | 22% |
①该反应的焓变△H 0,熵变△S___0(填>、<或=)。
②用甲醚作为燃料电池原料,在碱性介质中该电池负极的电极反应式 。若以1.12 L·min-1(标准状况)的速率向该电池中通入甲醚(沸点为-24.9 ℃),用该电池电解500 mL 2 mol·L-1 CuSO4溶液,通电0.50 min后,理论上可析出金属铜 g。
(1)C(s)+2H2O(g) CO2(g)+ 2H2 (g)(2分)
CO2(g)+ 2H2 (g)(2分)
(2)①12.8 (1分,不写单位不扣分,写错单位不得分) ②C (2分)③ AD(2分)
(3)CO2(g)+3H2(g)=CH3OH(l)+H2O(l) △H=-131.9kJ/mol(2分)
(4)①<(1分),<(1分)
②CH3OCH3 -12e- +16OH-=2CO32- +11H2O(2分) 9.6(2分)
解析试题分析:(1)表达式中分子为产物,分母为反应物,因为有二氧化碳生成,故还有固体碳参加,固体不写在平衡常数表达式中;
(2)①将容器甲中的相关数据代入平衡常数表达式中,注意将物质的量转化成平衡时的浓度;②三分钟水的转化量为1.2mol,因为起始时浓度大,反应速率快,故1.5分钟水的转化量大于0.6mol,故1.5分钟时水的浓度小于1.4mol/L;(3)写出二氧化碳和氢气反应生成甲醇和水的化学方程式、甲醇和氢气燃烧热的化学方程式,根据盖斯定律得制取甲醇的反应的△H,写出让热化学方程式;(4)①温度升高,二氧化碳的转化率减小,故正反应为放热反应;因为气体系数和减小,故熵变小于零;②负极甲醚失去电子在碱性溶液中生成碳酸根离子和水,通入的甲醚失去电子总数等于铜离子得到电子总数,根据电子守恒算出析出铜的质量。
考点:化学平衡常数表达式、化学平衡的移动、盖斯定律的应用、电极反应式的书写和应用电子守恒计算等知识

 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案(9分)如图所示,把试管放入盛有25℃的饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入5mL盐酸于试管中。试回答下列回答: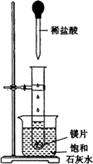
(1)实验中观察到的现象是____________________。(选填代号)
| A.试管中镁片逐渐溶解 | B.试管中产生无色气泡 |
| C.烧杯外壁变冷 | D.烧杯底部析出少量白色固体 |
(3)写出有关反应的离子方程式________________。
(4)由实验推知,MgCl2溶液和H2的总能量________(填“大于”“小于”“等于”)镁片和盐酸的总能量。
天然气、重油、煤都可以与水反应制得氢气。下表是某合成氨厂采用不同原料时的相对投资费用和能量消耗的数据。
| 原料 | 天然气 | 重油 | 煤 |
| 相对投资费用 | 1.0 | 1.5 | 2.0 |
| 能量消耗/J·t-1 | 28×109 | 38×109 | 48×109 |
请回答下列问题。
(1)依据上表信息,你认为采用________为原料最好。
(2)请写出甲烷在高温、催化剂的作用下与水蒸气反应生成氢气和一氧化碳的化学方程式:
____________________________________________
(3)已知C(s)、CO(g)和H2(g)完全燃烧的热化学方程式分别为:
C(s)+O2(g)=CO2(g);ΔH=-394 kJ·mol-1①
2CO(g)+O2(g)=2CO2(g);ΔH=-566 kJ·mol-1②
2H2(g)+O2(g)=2H2O(g);ΔH=-484 kJ·mol-1③
试写出由C与水蒸气在高温条件下反应生成氢气与一氧化碳的热化学方程式:__________________________________。
利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产。请回答下列问题:
(1)已知:N2(g)+O2(g) = 2NO(g) △H=+180.5kJ/mol
N2(g)+3H2(g)  2NH3(g) △H=-92.4kJ/mol
2NH3(g) △H=-92.4kJ/mol
2H2(g)+O2(g) = 2H2O(g) △H=-483.6kJ/mol
写出氨气经催化氧化完全生成一氧化氮气体和水蒸气的热化学方程式为
。
(2)某科研小组研究:在其他条件不变的情况下,改变起始物氢气的物质的量对N2(g)+3H2(g)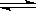 2NH3(g)反应的影响。
2NH3(g)反应的影响。
实验结果如图所示: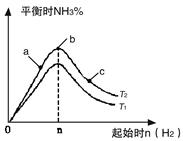
(图中T表示温度,n表示物质的量)
①图像中T2和T1的关系是:T2 T1(填“高于”“低于”“等于”“无法确定”)
②比较在a、b、c三点所处的平衡状态中,反应物N2 的转化率最高的是(填字母)。 。
③若容器容积为1L,在起始体系中加入1mol N2 ,n=3mol反应达到平衡时H2的转化率为60%,则此 条件下(T2),反应的平衡常数K= 。保持容器体积不变,再向容器中加入1mol N2,3mol H2反应达到平衡时,氢气的转化率将
(填“增大”、“减”或“不变”)。
(3)N2O5是一种新型硝化剂,其性质和制备受到人们的关注。
①一定温度下,在恒容密闭容器中N2O5可发生下列反应:
2N2O5(g)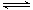 4NO2(g)+O2(g) ΔH>0下表为反应在T1温度下的部分实验数据
4NO2(g)+O2(g) ΔH>0下表为反应在T1温度下的部分实验数据
| t/s | 0 | 50 | 100 |
| c(N2O5)/mol·L—1 | 5.0 | 3.5 | 2.4 |
则50s内NO2的平均生成速率为 。
②现以H2、O2、熔融盐Na2CO3组成的燃料电池,采用电解法制备N2O5,装置如图所示,其中Y为CO2。
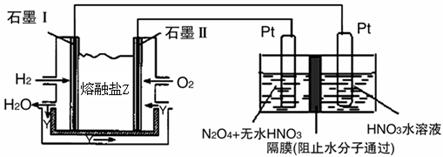
写出石墨I电极上发生反应的电极反应式 。
在电解池中生成N2O5的电极反应式为 。
作为国家正在实施的“西气东输”工程终点站——上海将逐步改变以煤、石油为主的能源结构,这对解决城市环境污染意义重大。
(1)目前上海大部分城市居民所使用的燃料主要是管道煤气,浦东新区居民
开始使用东海天然气作为民用燃料,管道煤气的主要成分是CO、H2和少量
烃类,天然气的主要成分是CH4,它们燃烧的化学方程式为:
2CO+O2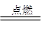 2CO2 2H2+O2
2CO2 2H2+O2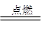 2H2O CH4+2O2
2H2O CH4+2O2 CO2+2H2O
CO2+2H2O
根据以上化学方程式判断:燃烧相同体积的管道煤气和天然气,消耗空气体积较大的是 ,因此燃烧管道煤气的灶具如需改烧天然气,灶具的改进方法是 进风口(填“增大”或“减小”),如不作改进可能产生的不良结果是 。
(2)管道煤气中含有的烃类,除甲烷外,还有少量乙烷、丙烷、丁烷等,它们的某些性质如下:
| | 乙烷 | 丙烷 | 丁烷 |
| 熔点/℃ | -183.3 | -189.7 | -138.4 |
| 沸点/℃ | -88.6 | -42.1 | -0.5 |
试根据以上某个关键数据解释冬天严寒的季节有时管道煤气火焰很小,并且呈断续状态的原因是___________________________。

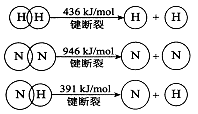
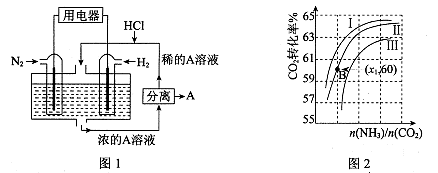
 CO(NH2)2(l)+ H2O(g)。工业生产时,原料气带有水蒸气。图2表示CO2的转化率与氨碳比
CO(NH2)2(l)+ H2O(g)。工业生产时,原料气带有水蒸气。图2表示CO2的转化率与氨碳比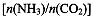 、水碳比
、水碳比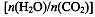 的变化关系。
的变化关系。 H2O(g) ΔH="+44" kJ·mol-1则16 g液态肼与液态双氧水反应生成液态水时放出的热量是 kJ。
H2O(g) ΔH="+44" kJ·mol-1则16 g液态肼与液态双氧水反应生成液态水时放出的热量是 kJ。