��Ŀ����
����Ŀ��FeCl3��һ�ֺ���Ҫ�����Σ���Ҫ������ˮ����������Ч���á��۸���˵��ŵ㡣��ҵ�Ͽɽ���м���������У�������FeCl2����ͨ��Cl2�������Ʊ�FeCl3��Һ��
��1������״���µ�a L�Ȼ�����������100 gˮ�У��õ�������ܶ�Ϊb g��mL��1�������������ʵ���Ũ����______________________��
��2����100 mL��FeBr2��Һ��ͨ���״����Cl2 3.36 L����Ӧ�����Һ��Cl����Br�������ʵ���Ũ����ȣ���ԭFeBr2��Һ�����ʵ���Ũ��Ϊ__________________��
��3��FeCl3��Һ����������ˮ���侻ˮ��ԭ��Ϊ____________________________________(�����ӷ���ʽ��ʾ)����100 mL 2 mol��L��1��FeCl3��Һ��ˮʱ�����ɾ��о�ˮ���õ�����________(����������������������С����)0.2NA��
���𰸡� ![]() mol��L��1 2 mol��L��1 Fe3����3H2O=Fe(OH)3(����)��3H�� С��
mol��L��1 2 mol��L��1 Fe3����3H2O=Fe(OH)3(����)��3H�� ��
��������(1)�Ȼ�������ʵ���n=![]() =
=![]() mol���Ȼ��������m=n��M=
mol���Ȼ��������m=n��M=![]() m mol��36.5g/mol=
m mol��36.5g/mol=![]() g����Һ�����V=
g����Һ�����V=![]() =
=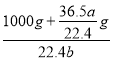 ��10-3L=����C=
��10-3L=����C=![]() =
=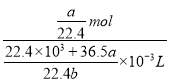 =
=![]() molL-1����(2)����������ԭ��Ӧ�Ĺ��ɣ�����������Fe2������Ӧ����Һ��Cl����Br�������ʵ���Ũ����ȣ�������Һ����Fe2������FeBr3��FeCl3��n(Cl��)��
molL-1����(2)����������ԭ��Ӧ�Ĺ��ɣ�����������Fe2������Ӧ����Һ��Cl����Br�������ʵ���Ũ����ȣ�������Һ����Fe2������FeBr3��FeCl3��n(Cl��)��![]() ��2��0.3 mol��n(Br��)�����ݵ���غ㼰ԭ���غ�֪��n(Fe3��)��0.2 mol��n(Fe2��)����c(FeBr2)��
��2��0.3 mol��n(Br��)�����ݵ���غ㼰ԭ���غ�֪��n(Fe3��)��0.2 mol��n(Fe2��)����c(FeBr2)��![]() ��2 mol��L��1��(3)Fe3����ˮ�з���ˮ�⣺Fe3����3H2O
��2 mol��L��1��(3)Fe3����ˮ�з���ˮ�⣺Fe3����3H2O![]() Fe(OH)3(����)��3H�������ɵ�Fe(OH)3��������������ã���������Һ�е��������ӡ�Fe3����ˮ���ǿ��淴Ӧ����Fe(OH)3�����еĽ����������ɶ��Fe(OH)3��ɵļ����壬�������ɵ�Fe(OH)3����������ĿС��0.2NA��
Fe(OH)3(����)��3H�������ɵ�Fe(OH)3��������������ã���������Һ�е��������ӡ�Fe3����ˮ���ǿ��淴Ӧ����Fe(OH)3�����еĽ����������ɶ��Fe(OH)3��ɵļ����壬�������ɵ�Fe(OH)3����������ĿС��0.2NA��

 ��У��ʦ������ҵ���Ӻ����Ծ�ϵ�д�
��У��ʦ������ҵ���Ӻ����Ծ�ϵ�д� ȫ�̽��ϵ�д�
ȫ�̽��ϵ�д�