题目内容
17.下列说法正确的是( )| A. | Ca2+、K+、Cl-、S2-四种离子的半径依次减小 | |
| B. | 熔融的NaHSO4中阴阳离子的数目比为1:2 | |
| C. | 氢化锂三兄弟--LiH、LiD、LiT三种物质的质子数之比为4:5:6 | |
| D. | 一个乙醛分子中存在7对共用电子 |
分析 A、电子层越多,半径越大,核内质子数越多,半径越小;
B、熔融的NaHSO4中存在钠离子和硫酸氢根离子;
C、质子数是构成微粒的各个原子数的质子数之和;
D、根据乙醛分子的结构式来判断电子对数.
解答 解:A、电子层越多,半径越大,核内质子数越多,半径越小,所以Ca2+、K+、Cl-、S2-四种离子的半径依次增大,故A错误;
B、熔融的NaHSO4中存在钠离子和硫酸氢根离子,阴阳离子的数目比为1:1,故B错误;
C、LiH、LiD、LiT三种物质的质子数之比为1:1:1,故C错误;
D、乙醛分子存在4个C-H键,一个C=O,一个C-C键,即存在7对共用电子,故D正确.
故选D.
点评 本题综合考查元素周期律的应用、原子结构和元素的性质等综合知识,注意知识的归纳和梳理是关键,难度中等.

练习册系列答案
相关题目
7.只含C、H、O三种元素的有机物W,其蒸气的密度是NH3的6倍(相同条件下),取一定量的有机物W完全燃烧,生成CO2和H2O的质量比为22:9,则W能发生水解反应的结构(不考虑立体结构) 共有( )
| A. | 11种 | B. | 10种 | C. | 9种 | D. | 8种 |
12.2010年上海世博会的主题是“城市,让生活更美好”.下列叙述中不正确的是( )
| A. | 世博会前期,净化自来水时加入ClO2作为消毒剂 | |
| B. | 世博会期间,利用可降解的“玉米塑料”替代一次性饭盒,可防止产生白色污染 | |
| C. | 世博停车场安装催化光解设施,可将汽车尾气中的CO和NO反应生成无毒气体 | |
| D. | 世博会中国馆一“东方之冠”使用的钢筋混凝土属于高分子化合物 |
2.下列有关化学反应的说法正确的是( )
| A. | 在氧化还原反应中,阴离子只能发生氧化反应 | |
| B. | 碳酸钠溶液显碱性:CO32-+2H2O?H2CO3+2OH- | |
| C. | 有些吸热反应不需要加热也能进行 | |
| D. | 1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热 |
9.下列有关实验装置的说法中正确的是( )
| A. | 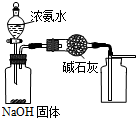 用图装置制取干燥纯净的NH3 | |
| B. | 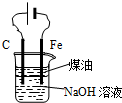 用图装置实验室制备Fe(OH)2 | |
| C. |  用图装置可以完成“喷泉”实验 | |
| D. |  用图装置测量Cu与浓硝酸反应产生气体的体积 |
6.某电池以K2FeO4和Zn为电极材料,KOH溶液为电解溶质溶液.下列说法正确的是( )
| A. | 电子由Zn电极流出,经KOH溶液流向正极 | |
| B. | 正极反应式为2FeO42-+10H++6e-=Fe2O3+5H2O | |
| C. | 该电池放电过程中电解质溶液浓度不变 | |
| D. | 电池工作时OH-向负极迁移 |
7.化学反应2Na+2CH3CH2OH→2CH3CH2ONa+H2↑的反应类型是( )
| A. | 化合反应 | B. | 分解反应 | C. | 置换反应 | D. | 复分解反应 |
