��Ŀ����
����Ŀ��A��B��C��D��E���Ƕ�����Ԫ�أ�ԭ��������������A��B����ͬһ���ڣ�C��D��Eͬ����һ���ڣ�C��B�ɰ�ԭ�Ӹ�����2��1��1��1�ֱ��γ��������ӻ�������ң�Aԭ�ӵ������������ȴ�����������3����E�ǵؿ��к�����ߵĽ���Ԫ�أ�����������Ϣ�ش��������⣺
��1��DԪ�������ڱ��е�λ���� �� ������Ϊ14��Eԭ�ӿɱ�ʾΪ ��
��2��д����A��C�γɵĻ�����Ļ�ѧʽ �� �û����������γɣ�
��3��A��B��C��D��E����Ԫ�ص����Ӱ뾶��С�����˳�����������ӷ�����д����
��4��д��ʵ������ȡA����̬�⻯��Ļ�ѧ����ʽ�� ��
��5�������Ƚ�D��E������ǿ����ʵ�鷽���� ��
���𰸡�
��1���������ڵڢ�A�壻27Al
��2��Na3N������
��3��Al3+��Mg2+��Na+��O2����N3��
��4��2NH4Cl+Ca��OH��2 ![]() CaCl2+2NH3��+2H2O
CaCl2+2NH3��+2H2O
��5��þ����ˮ���Է�Ӧ����������þ����������������ˮ����Ӧ
���������⣺A��B��C��D��E���Ƕ�����Ԫ�أ�ԭ��������������Aԭ�ӵ������������ȴ������Ӳ��3����ԭ��ֻ����2�����Ӳ㣬����������Ϊ5����AΪNԪ�أ�E�ǵؿ��к�����ߵĽ���Ԫ�أ���EΪAl��A��B����ͬһ���ڣ�C��D��Eͬ����һ���ڣ���CΪNa��DΪMg��C��B�ɰ�ԭ�Ӹ�����2��1��1��1�ֱ��γ��������ӻ�������ң���BΪO����ΪNa2O����ΪNa2O2 ��
��1.��DΪMgԪ�أ������ڱ��е�λ���ǣ��������ڵڢ�A�壬������Ϊ14��Alԭ�ӿɱ�ʾΪ27Al�����Դ��ǣ��������ڵڢ�A�壻27Al��
��2.����A��C�γɵĻ�����Ļ�ѧʽNa3N���������ӻ�����ɺ������Ӽ������Դ��ǣ�Na3N�����ӣ�
��3.�����Ӳ�ṹ��ͬ�����ӣ��˵����Խ�����Ӱ뾶ԽС�����ӵ��Ӳ�Խ�����Ӱ뾶Խ�����Ӱ뾶��Al3+��Mg2+��Na+��O2����N3�� �� ���Դ��ǣ�Al3+��Mg2+��Na+��O2����N3����
��4.��A����̬�⻯��Ϊ������ʵ�����Ʊ������Ļ�ѧ����ʽΪ��2NH4Cl+Ca��OH��2 ![]() CaCl2+2NH3��+2H2O�����Դ��ǣ�2NH4Cl+Ca��OH��2
CaCl2+2NH3��+2H2O�����Դ��ǣ�2NH4Cl+Ca��OH��2 ![]() CaCl2+2NH3��+2H2O��
CaCl2+2NH3��+2H2O��
��5.�����ݽ�������ˮ�ķ�Ӧ��ȷ�������Ļ����ԣ������ʵ��Ϊ��þ����ˮ���Է�Ӧ����������þ����������������ˮ����Ӧ��
���Դ��ǣ�þ����ˮ���Է�Ӧ����������þ����������������ˮ����Ӧ��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ���������ƣ�NaNO2����ۿ���ʳ��������ζ����һ�ֳ��õķ�ɫ���ͷ���������ʹ�ù�����ʹ���ж���ijѧϰС����������������������ʵ�飺
��ʵ��������ȡNaNO2
��С���Ȳ�������֪����2NO+Na2O2 ��2NaNO2��2NO2+Na2O2 ��2NaNO3����NO�ܱ����Ը����������ΪNO3����Ȼ�������ȡװ������ͼ���г�װ����ȥ����
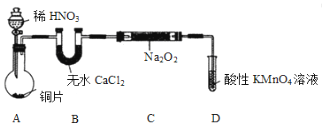
��1��װ��A������ʢ��ϡHNO3��Һ����������Ϊ________��д��װ��A�з�����Ҫ��Ӧ�����ӷ���ʽ��__________��
��2��װ��D��������____________��
��3�����û��Bװ�ã�C�з����ĸ���Ӧ�Ļ�ѧ����ʽ��_______ ����______��
��4����ͬѧ�����װ�����������ú����ʵ�飬�����Ƶõ�NaNO2�л��н϶��NaNO3���ʡ��������ַ����������NaNO2����________��
A.��B�е�ҩƷ��Ϊ��ʯ�� B.��ϡ���ỻΪŨ����
C.ʵ�鿪ʼǰͨһ��ʱ��CO2 D.��A��B֮������ʢ��ˮ��ϴ��ƿ
��ʵ�������ⶨNaNO2��Ʒ��NaNO3�ĺ���
���裺��1������KMnO4����Һ���ữ���ữKMnO4����Ӧѡ��________���ѧʽ��
��2����֪��������Һ�У�NO2-�ɽ�MnO4-��ԭΪMn2+��Ϊ�ⶨ�������Ƶĺ�������ȡ4.000 g��Ʒ����ˮ���250 mL��Һ��ȡ25.00 mL��Һ����ƿ�У���0.1000 mol��L-1����KMnO4��Һ���еζ�������KMnO4 20.00mL������KMnO4��������______��_______���������ù������������Ƶ���������__________�����������һλС����
����չʵ��������ѧϰС��Ϊ���˽�����Ԫ�ص�һЩ���ͻ���������ʣ�����������ʵ��̽����
����֪:����ͭ���ȷֽ���������ͭ������,�����¶Ȳ�ͬ,������ɷ�Ҳ��ͬ������ɷ� ������SO2��SO3��O2�е�һ�֡����ֻ����֡�����ͨ�����һ̽����ʵ�飬�ⶨ��Ӧ������SO2��SO3��O2�����ʵ�������������ȷ�������ʵĻ�ѧ���������Ӷ�ȷ��CuSO4�ֽ�Ļ�ѧ����ʽ��ʵ���õ���������ͼ��ʾ:
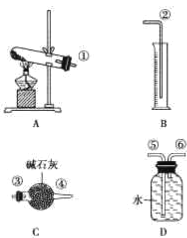
��1���������
����������ijɷֿ���ֻ��________һ��;
����������ijɷֿ��ܺ���________����;
����������ijɷֿ��ܺ���SO2��SO3��O2���֡�
��2��ʵ��̽��
ʵ���������(��)����֪ʵ�����ʱ������ͭ��ȫ�ֽ⡣
��ش�����������
��������װ̽��ʵ���װ�ã����������ҵķ����������ӿڵ�����˳��Ϊ______ (�����)��
�����ڼ���ʱ���¶Ȳ�ͬ��ʵ����������������Ҳ��ͬ������������
ʵ�� | ��ȡCuSO4������/g | ����C ���ӵ�����/g | ��Ͳ��ˮ���������ɱ�״������������/mL |
��һ�� | 6.4 | 2.88 | 224 |
�ڶ��� | 6.4 | 2.56 | 448 |
��ͨ�����㣬�ƶϳ���һ��͵ڶ����ʵ��������CuSO4�ֽⷴӦ�Ļ�ѧ����ʽ��
��һ��_________________�� �ڶ���_________________��
����Ŀ��A��B��C��D��EΪԭ���������������Ԫ�أ�ֻ��E�����ڶ����ڣ������Ϣ���±���
Ԫ�� | A | B | C | D | E |
��� | AԪ��ԭ�Ӻ�����3�����Ӳ㣬�������3�����ӣ� | ��Ԫ��C���γ����Ӹ����� | CԪ�ص�ԭ��K��L�������֮�ͱ�L��M�������֮�Ͷ�1������ | DԪ�ؿ��γ��������������һ�����γ��������Ҫ�ɷ� | �䵥������;��㷺�Ľ����� |
�ش��������⣨��ѧ�����е�Ԫ������Ӧ��Ԫ�ط��ű�ʾ����
��1��E��Ԫ�����ڱ��е�λ���� ��
��2��B��DԪ�ض�Ӧ����Է���������С���⻯�����ȷֽ������¶������⻯��Ļ�ѧʽ����
��3��д��B��C�γɻ�����ĵ���ʽ���� ��
��4������D�������������һ���Լ���������E3+�ķ����� ��
��5��д��A��C������������ˮ���ﷴӦ�����ӷ���ʽ�� ��