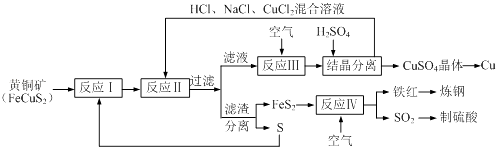
题目内容
【题目】25℃时,将0.01 mol CH3COONa和0.002 mol HCl溶于水,形成1 L混合溶液。
(1)该溶液中存在着三个平衡体系,用电离方程式或离子方程式表示:
①_______________________;②_______________________;③_______________________。
(2)溶液中共有_______种不同的粒子(指分子和离子)。
(3)在这些粒子中,浓度为0.01 mol·L1的是____________,浓度为0.002 mol·L1的是____________。
(4)____________和____________两种粒子物质的量之和等于0.01 mol。
【答案】(1)①CH3COO+H2O![]() CH3COOH+OH(2分)
CH3COOH+OH(2分)
②CH3COOH![]() CH3COO+H+(2分)
CH3COO+H+(2分)
③H2O![]() H++OH(2分)
H++OH(2分)
(2)7(2分)
(3)Na+(1分) Cl(1分)
(4)CH3COOH(1分) CH3COO(1分)
【解析】溶液中存在CH3COO,则有水解平衡:CH3COO+H2O![]() CH3COOH+OH;溶液中含有CH3COONa与HCl生成的弱电解质CH3COOH,则有CH3COOH的电离平衡:CH3COOH
CH3COOH+OH;溶液中含有CH3COONa与HCl生成的弱电解质CH3COOH,则有CH3COOH的电离平衡:CH3COOH![]() CH3COO+H+;溶液中还存在水的电离平衡:H2O
CH3COO+H+;溶液中还存在水的电离平衡:H2O![]() H++OH。溶液中存在的离子有:Cl、Na+、CH3COO、H+、OH,分子有H2O、CH3COOH;能够水解的离子及电离(微弱)产生的离子随外界条件的变化浓度发生变化,故浓度为定值的是强酸、强碱对应的阴、阳离子,即c(Na+)=0.01 mol·L1,c(Cl)为0.002 mol·L1。而由物料守恒c(CH3COO)+c(CH3COOH)=0.01 mol·L1,故CH3COO和CH3COOH的物质的量之和为0.01 mol。
H++OH。溶液中存在的离子有:Cl、Na+、CH3COO、H+、OH,分子有H2O、CH3COOH;能够水解的离子及电离(微弱)产生的离子随外界条件的变化浓度发生变化,故浓度为定值的是强酸、强碱对应的阴、阳离子,即c(Na+)=0.01 mol·L1,c(Cl)为0.002 mol·L1。而由物料守恒c(CH3COO)+c(CH3COOH)=0.01 mol·L1,故CH3COO和CH3COOH的物质的量之和为0.01 mol。