题目内容
(14分)下图表示实验室在没有通风橱的条件下制备氯气时设计的装置,图中a、b是可控制的弹簧铁夹。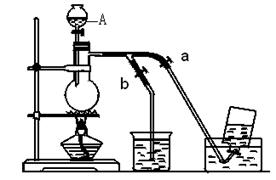
(1)仪器A的名称是 ;水槽中应盛放的是 ;烧杯中反应的化学方程式 ;
(2)在收集氯气时,应 。当氯气收集完毕时应 。(填如何控制a、b)
(3)若要制得标准状况下的Cl2 0.672L,理论上需要MnO2的物质的量是 mol。
(4)实验室也可在不加热的条件下用高锰酸钾和浓盐酸反应制取氯气,反应的化学方程式如下:
2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O
该反应中,氧化剂是 ,氧化产物是 ;当有1mol电子发生转移时,
生成氯气的体积为 (标准状况),请用双线桥表示该氧化还原反应。
2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O
(1)分液漏斗;饱和食盐水;Cl2+2NaOH=NaCl+NaClO+H2O。
(2)打开a, 关闭b;打开b,关闭a。 (3)0.03 mol。
(4)氧化剂是 KMnO4,氧化产物是Cl2;11.2L
解析试题分析:(1)仪器A的名称叫分液漏斗,为了降低氯气的溶解度,水槽应该放饱和食盐水,烧杯中应该放NaOH溶液吸收多余的氯气,反应的化学方程式为Cl2+2NaOH=NaCl+NaClO+H2O。
(2)收集氯气时,应该打开a关闭b。收集完毕后应该关闭a,打开b。
(3)根据反应:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O,可知制得标准状况下的Cl2 0.672,理论上需要MnO2的物质的量是0.03 mol。
MnCl2+Cl2↑+2H2O,可知制得标准状况下的Cl2 0.672,理论上需要MnO2的物质的量是0.03 mol。
(4)根据反应2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O,可知氧化剂是KMnO4,氧化产物是Cl2,有1mol电子发生转移时,生成氯气的体积为11.2L。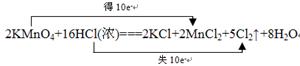

二氯化二硫(S2Cl2)是一种重要的化工原料,常用作橡胶硫化剂,改变生橡胶受热发粘、遇冷变硬的性质。查阅资料可知S2Cl2具有下列性质:
| 物理性质 | 色态 | 挥发性 | 熔点 | 沸点 |
| 金黄色液体 | 易挥发 | -76℃ | 138℃ | |
| 化学性质 | 300 ℃以上完全分解 | |||
S2Cl2+Cl2 2SCl2 2SCl2 | ||||
| 遇水反应生成SO2、S等产物 | ||||
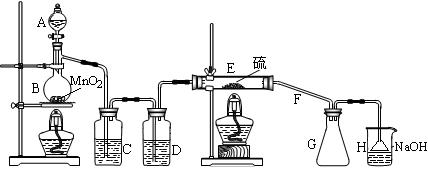
(1)仪器A的名称是 ,导管F除导气外还起的作用是 ;
(2)B中反应的离子方程式为 ;
(3)开始实验,打开分液漏斗的活塞,发现浓盐酸流出少量后即难以下滴,经检查分
液漏斗活塞没有堵塞,你认为应采取的措施是 ;
(4)装置C中的试剂是 ;如果缺少D装置,则对实验的影响是(用化学方程式表示) ;
(5)如果在加热E时温度过高,对实验结果的影响是 ;为了提高S2C12的纯度,关键的操作是控制好温度和 。
(6)设计装置H的目的是 ;烧杯中发生反应的离子方程式
是 。
二氯化二硫(S2Cl2)是一种重要的化工原料,常用作橡胶硫化剂,改变生橡胶受热发粘、遇冷变硬的性质。查阅资料可知S2Cl2具有下列性质:
|
物理性质 |
色态 |
挥发性 |
熔点 |
沸点 |
|
金黄色液体 |
易挥发 |
-76℃ |
138℃ |
|
|
化学性质 |
300 ℃以上完全分解 |
|||
|
S2Cl2+Cl2 |
||||
|
遇水反应生成SO2、S等产物 |
向熔融的硫中通以干燥、纯净的C12即可生成S2C12。下图是实验室制备S2Cl2的装置。

(1)仪器A的名称是 ,导管F除导气外还起的作用是 ;
(2)B中反应的离子方程式为 ;
(3)开始实验,打开分液漏斗的活塞,发现浓盐酸流出少量后即难以下滴,经检查分
液漏斗活塞没有堵塞,你认为应采取的措施是 ;
(4)装置C中的试剂是 ;如果缺少D装置,则对实验的影响是(用化学方程式表示) ;
(5)如果在加热E时温度过高,对实验结果的影响是 ;为了提高S2C12的纯度,关键的操作是控制好温度和 。
(6)设计装置H的目的是 ;烧杯中发生反应的离子方程式
是 。



 2SCl2
2SCl2