题目内容
(11分)把铝、铁混合物1.1 g溶于200 mL 5mol/L盐酸中,反应后盐酸的浓度变为4.6mol/L(溶液体积变化忽略不计).
求:(1)反应中产生的气体的总体积(标准状况)为多少L?
(2)生成的FeCl2的物质的量浓度是多少?(要有解答过程,否则不得分。)
【答案】
(11分)(1)消耗HCl的物质的量:0.2L×5mol/L-0.2L×4.6mol/L=0.08mol n(H2)= 0.04mol (2分)
V=0. 04mol×22.4L/ mol=0.896L (2分)
(2)设Al、Fe的物质的量分别为x、y
Al~3HCl Fe~2HCl
x 3x y 2y (2分)
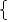 27g/mol×x+56g/mol×y=1.1g
27g/mol×x+56g/mol×y=1.1g
3x+2y=0.08mol (2分)
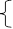 x=0.02mol
x=0.02mol
得 y=0.01mol (1分)
C(FeCl2)= 0.01mol/0.2L=0.05 mol/L (2分)
【解析】略

练习册系列答案
 天天练口算系列答案
天天练口算系列答案
相关题目