题目内容
常温下体积相同的下列四种溶液:①pH=3的盐酸 ②pH=3的醋酸溶液 ③pH=11的氨水 ④pH=11的NaOH溶液。下列说法中,正确的是
| A.②和④混合,所得混合溶液的pH大于7 |
| B.将四种溶液分别稀释到体积为原的100倍,溶液pH大小顺序③>④>②>① |
| C.③和④分别与足量稀硫酸中和,消耗硫酸的体积③=④ |
| D.①和③混合,所得混合溶液中c(H+)+ c(NH4+)=c(Cl-)+c(OH-) |
D
试题分析:②和④混合,因为醋酸为弱酸,醋酸的浓度远远大于0.001mol?L?1,而NaOH为强碱,其浓度为0.001mol?L?1,等体积混合,醋酸过量,混合后pH小于7,故A项错误;醋酸、氨水为弱酸、弱碱,加水稀释能促进电离,故溶液pH大小顺序为③>④>①>②,B项错误;因为氨水浓度大,所以消耗硫酸的体积③>④,故C项错误;①和③混合,氨水过量,溶质为NH4Cl和HCl,含有的离子为:NH4+、Cl?、H+、OH?,根据电荷守恒可得:c(H+)+ c(NH4+)=c(Cl-)+c(OH-),故D项正确。

练习册系列答案
 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案
相关题目
 I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫红色,说明KI3在CCl4中的溶解度比在水中的大
I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫红色,说明KI3在CCl4中的溶解度比在水中的大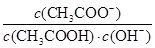 减小
减小