题目内容
【题目】燃煤废气中的氮氧化物(NOx)、CO2、SO2等气体,常要采用不同方法处理,以实现节能减排、废物利用等。
(1)下列为二氧化硫和氮的氧化物转化的部分环节:
①已知:2SO2(g)+O2(g)![]() 2SO3(g) △H=-196.6 kJmol-1
2SO3(g) △H=-196.6 kJmol-1
2NO(g)+O2(g)![]() 2NO2(g) △H=-113.0 kJ·mol-1
2NO2(g) △H=-113.0 kJ·mol-1
则SO2气体与NO2气体反应生成SO3气体和NO气体的热化学方程式为_________。
②一定条件下,工业上可通过下列反应实现燃煤烟气中液态硫的回收,其中Y是单质:SO2(g)+2CO(g) ![]() 2X(g)+Y(l)。为了测定在某种催化剂作用下的反应速率,某化学兴趣小组在某温度下、固定容器中用超灵敏气体传感器测得不同时间的SO2和CO浓度如下表:
2X(g)+Y(l)。为了测定在某种催化剂作用下的反应速率,某化学兴趣小组在某温度下、固定容器中用超灵敏气体传感器测得不同时间的SO2和CO浓度如下表:
时间/s | 0 | 1 | 2 | 3 | 4 |
c(SO2)/mol·L-1 | 1.00 | 0.50 | 0.23 | 3.00×10-37 | 3.00×10-37 |
c(CO)/mol·L-1 | 4.00 | 3.00 | 2.46 | 2.00 | 2.00 |
X的化学式为___________;当时间为第4 s时,2v(SO2)正____(填“>”“=”或“<”)v(X)逆。
(2)有科学家经过研究发现,在210~290℃、催化剂条件下用H2可将CO2转化生成甲醇蒸气和水蒸气。一定条件下,往2 L恒容密闭容器中充入1 mol CO2和3. 0 mol H2,在不同催化剂作用下,相同时间内CO2的转化率随温度变化如图所示:

①催化剂效果最佳的是催化剂
②此反应在a点时已达平衡状态,a点的转化率比c点高的原因是___________。已知容器内的起始压强为100 kPa,则图中c点对应温度下反应的平衡常数Kp=______(保留两位有效数字)(Kp为以分压表示的平衡常数, 分压=总压×物质的量分数)。
【答案】SO2(g) +NO2(g) ![]() SO3(g)+NO(g) △H=-41.8 kJ·mol-1 CO2 = I a点达到平衡,c点温度升高,反应是放热反应,平衡逆向,转化率减小
SO3(g)+NO(g) △H=-41.8 kJ·mol-1 CO2 = I a点达到平衡,c点温度升高,反应是放热反应,平衡逆向,转化率减小 ![]()
【解析】
⑴①根据盖斯定律,第一个方程式减去第二个方程式,再除以2得到热化学方程式;②Y为S,根据原子守恒思想得出X的化学式;当时间为第4 s时,已经达到平衡,则速率比等于计量系数比。
⑵①T3温度以前,相同温度下,催化剂Ⅰ的催化效率更高;②该反应是放热反应,温度越高,平衡逆向移动,建立三段式,先计算平衡后的压强,再根据压强平衡常数计算。
⑴①第一个方程式减去第二个方程式,再除以2得到SO2气体与NO2气体反应生成SO3气体和NO气体的热化学方程式为SO2(g) +NO2(g) ![]() SO3(g) +NO(g) △H=-41.8 kJ·mol-1;故答案为:SO2(g) +NO2(g)
SO3(g) +NO(g) △H=-41.8 kJ·mol-1;故答案为:SO2(g) +NO2(g) ![]() SO3(g) +NO(g) △H=-41.8 kJ·mol-1。
SO3(g) +NO(g) △H=-41.8 kJ·mol-1。
②Y为S,根据原子守恒思想得出X的化学式为CO2;当时间为第4 s时,已经达到平衡,则速率比等于计量系数比,故2v(SO2)正 = v(X)逆;故答案为:CO2;=。
⑵①T3温度以前,相同温度下,催化剂Ⅰ的催化效率更高;故答案为:I。
②该反应是放热反应,温度越高,平衡逆向移动,因此a点的转化率比c点高的原因是a点达到平衡,c点温度升高,反应是放热反应,平衡逆向,转化率减小;
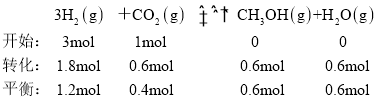
利用压强之比等于物质的量之比,![]() ,反应后的压强为
,反应后的压强为![]() ,
,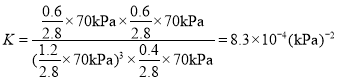 ;故答案为:a点达到平衡,c点温度升高,反应是放热反应,平衡逆向,转化率减小;
;故答案为:a点达到平衡,c点温度升高,反应是放热反应,平衡逆向,转化率减小;![]() 。
。

 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案