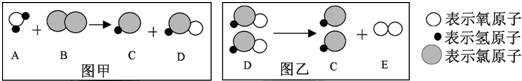
题目内容
氧化还原反应中实际上包含氧化和还原两个过程.下面是一个还原过程的反应式:NO3-+4H++3e-→NO+2H2O,KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生.
(1)写出并配平该氧化还原反应的方程式: .
(2)反应中硝酸体现了 、 的性质.
(3)反应中若产生0.2mol气体,则转移电子的物质的量是 mol.
(1)写出并配平该氧化还原反应的方程式:
(2)反应中硝酸体现了
(3)反应中若产生0.2mol气体,则转移电子的物质的量是
考点:氧化还原反应
专题:氧化还原反应专题
分析:KMnO4、Na2CO3、Fe2(SO4)3中Mn、C、Fe元素都处在最高价,则具有氧化性,只有Cu2O中Cu处在较低价,则具有还原性,在NO3-+4H++3e→NO+2H2O中发生的氧化剂被还原的反应,则该氧化还原反应为Cu2O+HNO3→NO↑+Cu(NO3)2+H2O,Cu元素由+1价升高到+2价,N元素由+5价降低到+2价,由电子守恒及质量守恒定律,配平的化学反应为3Cu2O+14HNO3═2NO↑+6Cu(NO3)2+7H2O,结合氧化还原反应基本概念来解答.
解答:
解:(1)KMnO4、Na2CO3、Fe2(SO4)3中Mn、C、Fe元素都处在最高价,则具有氧化性,只有Cu2O中Cu处在较低价,则具有还原性,在NO3-+4H++3e→NO+2H2O中发生的氧化剂被还原的反应,则该氧化还原反应为Cu2O+HNO3→NO↑+Cu(NO3)2+H2O,Cu元素由+1价升高到+2价,N元素由+5价降低到+2价,由电子守恒及质量守恒定律,配平的化学反应为3Cu2O+14HNO3═2NO↑+6Cu(NO3)2+7H2O,
故答案为:14HNO3+3Cu2O═6Cu(NO3)2+2NO↑+7H2O;
(2)生成硝酸铜体现硝酸的酸性,生成NO体现硝酸的氧化性,故答案为:酸性;氧化性;
(3)若产生0.2mol气体,则转移电子为0.2mol×(5-2)=0.6mol,故答案为:0.6.
故答案为:14HNO3+3Cu2O═6Cu(NO3)2+2NO↑+7H2O;
(2)生成硝酸铜体现硝酸的酸性,生成NO体现硝酸的氧化性,故答案为:酸性;氧化性;
(3)若产生0.2mol气体,则转移电子为0.2mol×(5-2)=0.6mol,故答案为:0.6.
点评:本题考查氧化还原反应,为高考常见题型,注意把握元素的化合价及反应中的变化为解答的关键,侧重基本概念和转移电子数的考查,题目难度不大.

练习册系列答案
 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案
相关题目
下列设备工作时,将化学能转化为热能的是( )
A、 太阳能集热器 |
B、 硅太阳能电池 |
C、 燃气灶 |
D、 锂离子电池 |
下列对塑料的认识正确的是( )
| A、塑料属于天然有机高分子材料 |
| B、废弃塑料是造成“白色污染”的主要物质 |
| C、所有塑料都容易燃烧并产生有毒气体 |
| D、塑料给人类带来了污染,因此要禁止生产和使用 |
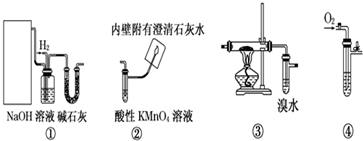
 .
.